
【题目】铜及其化合物应用广泛。
Ⅰ.氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下:

已知:CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易氧化。回答下列问题:
(1)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为_______________。
(2)步骤③中(NH4)SO3要适当过量,目的是使Cu2+充分还原,并保证Cu2+的还原速率和_____,其主要反应的离子方程式________________。已知NH4Cl、Cu2+的物质的量之比[n(NH4Cl]/n(Cu2+)]与Cu2+沉淀率的关系如下图所示,当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,原因是_____________________。

(3)步骤⑥中醇洗的目的是____________________________。
Ⅱ.以氧缺位铁酸铜(CuFe2O4-x)作催化剂,可利太阳能热化学循环法分解H2O制H2,其物质转化如图所示。
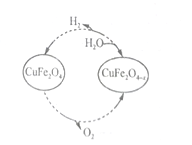
(4)氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为_______________。
(5)若x=0.15,则1mol CuFe2O4-x参与一次该循环,理论上能制得的H2体积为_______L(标准状况下)。
【答案】4Cu+NO3-+10H+ = 4Cu2++NH4++3H2O 防止CuCl被空气氧化 2Cu2++SO32-+ 2Cl-+H2O = 2CuCl↓+SO42-+2H+ 生成的氯化亚铜又溶解于氯化铵溶液中 有利于加快除去滤饼表面的水分 CuFe2O4-x+xH2O=CuFe2O4+xH2 3.36
【解析】
试题Ⅰ.(1)步骤①中由于酸性条件下硝酸根离子具有氧化性,可氧化Cu生成Cu2+,N元素被还原为最低价生成NH4+;(2)步骤③中铜离子与亚硫酸铵发生氧化还原反应生成CuCl,离子方程式是2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,(NH4)2SO3要适当过量,目的有:保证Cu2+的还原速率,防止CuCl被空气氧化;CuCl可溶于氯离子浓度较大的体系,当氯化铵用量增加到一定程度后氯化亚铜又溶解于氯化铵溶液中;(3)CuCl难溶于醇,乙醇沸点低,易挥发,用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化;Ⅱ. (4)根据图示,氧缺位铁酸铜(CuFe2O4-x)与水反应生成CuFe2O4和H2;(5)根据化学方程式计算x=0.15时,生成氢气的体积。
解析:Ⅰ.(1)步骤①中由于酸性条件下硝酸根离子具有氧化性,可氧化Cu生成Cu2+,N元素被还原为最低价生成NH4+,反应离子方程式是4Cu+NO3-+10H+ = 4Cu2++NH4++3H2O;(2)步骤③中铜离子与亚硫酸铵发生氧化还原反应生成CuCl,反应离子方程式是2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,(NH4)2SO3要适当过量,目的有:保证Cu2+的还原速率,(NH4)2SO3具有还原性,可以防止CuCl被空气氧化;CuCl可溶于氯离子浓度较大的体系,当氯化铵用量增加到一定程度后氯化亚铜又溶解于氯化铵溶液中,所以当氯化铵用量增加到一定程度后Cu2+的沉淀率减少;(3)CuCl难溶于醇,乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化;Ⅱ. (4)根据图示,氧缺位铁酸铜(CuFe2O4-x)与水反应生成CuFe2O4和H2,反应方程式是CuFe2O4-x+xH2O=CuFe2O4+xH2;(5)根据化学方程式CuFe2O4-x+xH2O=CuFe2O4+xH2,可知x=0.15时,1mol CuFe2O4-x参与生成0.15mol氢气,标准状况下的体积是3.36L。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 2.8 g环已烷含共价键数目为0.4NA
B. 过氧化钠与水反应,生成0.1 mol氧气时,转移的电子数为0.4NA
C. 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
D. 用惰性电极电解CuSO4溶液后,如果加入0.1 molCu(OH)2能使溶液复原,则电路中转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A+B―→C(放出能量)分两步进行:①A+B―→X(吸收能量),②X―→C(放出能量)。下列示意图中表示总反应过程中能量变化的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是

A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法
B. 若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法
D. 若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是
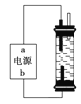
A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~500 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是________。
(2)写出C物质的化学式:________。
(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:____________________________;
反应④的离子方程式:____________________________;
反应⑥的化学方程式:____________________________。
(4)从能量变化的角度看,反应①②③中,属于ΔH<0的反应是________(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com