
【题目】水体富营养化可导致赤潮、水华等水污染现象。下列与水体富营养化密切相关的元素是
A. C B. O C. P D. S
科目:高中化学 来源: 题型:
【题目】磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图如下:
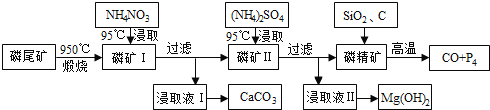
请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度_______________(填“高于”、“低于” )950℃;
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是________________,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是__________________________。
(3)磷精矿与SiO2、C发生反应时被还原的物质是_______________。
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示。
写出石墨Ⅰ电极上发生反应的电极反应式_______________,Na+向________(填写“石墨Ⅰ”或“石墨Ⅱ”)移动。
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸。
①常温下关于1 L 0.1 mol·L-1 HCOONa溶液,下列关系不正确的是____________。
a.c(H+)·c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,c(HCOOH)·c(OH-)的数值________(填写“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-![]() FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是
FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是

A.电解一段时间后,阳极室的c(OH-)增大
B.Na+由阴极室移向阳极室
C.阴极反应式:2H2O+2e-=H2↑+2OH-
D.电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A.H2SO4=H2+SO42-
B.NaOH=Na++O2-+H+
C.Ba(OH)2=Ba2++OH2-
D.CaCl2=Ca2++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是

选项 | a | b | c | c试管中现象 |
A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
C | 硼酸 | Na2CO3 | Na2SiO3溶液 | 析出白色沉淀 |
D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①水和植物油的混合物 ②提取白酒中的乙醇 ③氯化钠和单质溴的混合液。分离以上各混合液的正确方法依次( )
A、分液、萃取、蒸馏 B、萃取、蒸馏、分液
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据图1和图2所示,回答下列问题:

图1
(1)Y的化学式为__________________
(2)欲制备Na2S2O3,从氧化还原角度分析,合理的是______________(填序号)。
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(3)将X与O2混合,可生成淡黄色固体。该反应的氧化剂与还原剂物质的量之比为_____________。
(4)图2为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

图2
Ⅰ.①中反应的化学方程式是_____________。想要立即终止①的反应,最恰当的方法是__________。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
Ⅱ.④中棉花团的作用是_________________。
Ⅲ.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4用途广泛,以Cu为原料制CuSO4有多种方法。
(1)实验室可用Cu与浓硫酸反应制CuSO4。
① Cu与浓硫酸反应的化学方程式是________。
② 该方法制CuSO4存在的不足是________(写出任意一条)。
(2)实验小组采取如下方法制CuSO4。

实验表明,Fe3+能加快生成CuSO4的反应速率,加快原理可表述为:
i. 2Fe3+ + Cu = 2Fe2+ + Cu2+
ii. ……
ii的离子方程式是________。
(3)用电解的方法制CuSO4,如图所示。

① 与直流电源a 端相连的电极材料是________(填“铜片”或“石墨”)。
② 将进口处较浓硫酸替换为Na2SO4溶液进行实验,发现得到的CuSO4溶液pH比替换前升高,结合化学用语解释pH升高的原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com