
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4 ![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+ ![]() I2+3H2O
I2+3H2O
C. 向FeBr2溶液中通入足量氯气:2Fe2++2Br—+2Cl2 ![]() 2Fe3++Br2+4Cl
2Fe3++Br2+4Cl
D. 氯气通入氢硫酸中产生黄色沉淀:Cl2 + S2— ![]() 2Cl—+ S↓
2Cl—+ S↓
【答案】A
【解析】
A,沉淀转化的一般原则:向更容易沉淀的方向移动;B,氧化还原型离子反应要遵守电荷守恒,电子守恒;C,根据量的多少判断;D,在离子反应中,弱电解质氢硫酸不能拆开。
A. 硫酸钙溶解度大于碳酸钙,根据沉淀转化的一般原则,反应向更容易沉淀的方向进行,饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4 ![]() CaCO3+SO42,A正确;
CaCO3+SO42,A正确;
B. 根据电荷守恒, 酸化NaIO3和NaI的混合溶液:5I +IO3+6H+ ![]() 3I2+3H2O,B错误;
3I2+3H2O,B错误;
C. 在FeBr2溶液中通入足量氯气,氯气能将亚铁离子和溴离子全部氧化,按照亚铁离子和溴离子的物质的量之比为1:2进行反应,2Fe2++4Br—+3Cl2 ![]() 2Fe3++2Br2+6Cl,C错误;
2Fe3++2Br2+6Cl,C错误;
D. 氯气通入氢硫酸中产生黄色沉淀,由于氢硫酸是弱电解质,在离子反应书写时不能拆分,故Cl2 + H2S![]() 2Cl—+ S↓+2H+,D错误;
2Cl—+ S↓+2H+,D错误;
答案为A。


科目:高中化学 来源: 题型:
【题目】如图装置所示,是用氢氧燃料电池B进行的某电解实验:
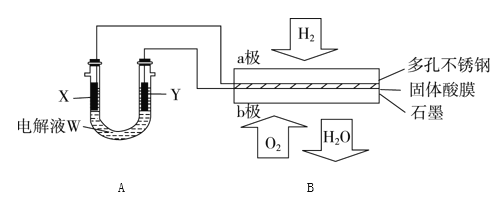
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是________。
A. Li2NH中N的化合价是-1
B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H-的离子半径相等
D. 此法储氢和钢瓶储氢的原理相同
(2)在电池B工作时:
①若用固体Ca(HSO4)2为电解质传递H+,则电子由________极流出,H+向______极移动(填“a”或“b ”)。
②b极上的电极反应式为_________。
③外电路中,每转移0.1 mol电子,在a极消耗________ L的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
①电解池中X极上的电极反应式是______________。在X极这边观察到的现象是____________。
②检验Y电极上反应产物的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种常见药物:①阿司匹林、②青霉素、③胃舒平、④麻黄碱。请回答下列问题。.
(1)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是_______(填序号)。
(2)滥用_______(填序号)药物会导致不良后果,若过量服用会引起中毒,应立即停药,并静脉注射![]() 溶液。
溶液。
(3)某同学胃酸过多,应选用的药物是______(填序号);抗酸药是治疗胃酸过多的一类药物,写出一种抗酸药中和胃酸的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验过程中需注重环境保护,下列操作不会引起空气污染的是
A. 加热KMnO4制氧气的试管,用浓盐酸洗涤
B. 用稀硝酸洗涤做过银镜实验的试管
C. 硝酸亚铁和硫酸废液一同倒入废液缸
D. 将打破的水银温度计用硫粉覆盖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某糕点的营养成分:
营养物质 | 蛋白质 | 油脂 | 淀粉 | 维生素类 | 碳酸钙 |
含量/ |
|
|
|
|
|
下列有关说法正确的是( )。
A.淀粉和纤维素属于糖类,且互为同分异构体
B.维生素是一种基本营养物质
C.淀粉、油脂、蛋白质都由碳、氢、氧三种元素组成
D.淀粉、油脂、蛋白质都为有机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
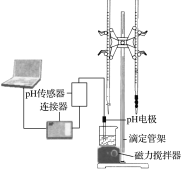
【题目】某化学小组设计了如图所示的数字化实验装置,研究常温下,向30mL0.1mol·L-1H2A溶液中逐滴加入等浓度NaOH溶液时pH的变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系(如图所示),下列说法错误的是( )
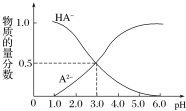
A.pH=4.0时,溶液中n(HA-)约为2.73×10-4mol
B.该实验应将左边的酸式滴定管换成右边的碱式滴定管
C.常温下,含有等物质的量浓度的NaHA与Na2A的混合溶液:pH=3.0
D.0.1mol·L-1NaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式![]() O2(g) +C2H2(g) =2 CO2(g) + H2O (g) ΔH = -1256 kJ·mol-1,下列正确的是( )
O2(g) +C2H2(g) =2 CO2(g) + H2O (g) ΔH = -1256 kJ·mol-1,下列正确的是( )
A.乙炔的燃烧热为1256 kJ·mol-1
B.若生成2 mol液态水,则ΔH = -2512 kJ·mol-1
C.若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ
D.若转移10 mol电子,则消耗2.5 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家以MoS2为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。下列说法错误的是( )

A. Li2SO4溶液利于MoS2对N2的活化
B. 两种电解质溶液环境下从N2→NH3的焓变不同
C. MoS2(Li2SO4溶液)将反应决速步(*N2→*N2H)的能量降低
D. N2的活化是N≡N键的断裂与N—H键形成的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,A物质的量浓度变为原来的60%,则ab(填“>、=、<”),简述其理由。
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,A物质的量浓度变为原来的60%,则ab(填“>、=、<”),简述其理由。
(2)在恒温时,在固定容器中充入N2O4,发生反应N2O4(g)![]() 2NO2(g),在达到平衡后,若又向容器中充入一定量的N2O4,当达到新平衡时,反应体系中NO2(g)的体积分数将(增大、减小、不变)。
2NO2(g),在达到平衡后,若又向容器中充入一定量的N2O4,当达到新平衡时,反应体系中NO2(g)的体积分数将(增大、减小、不变)。
(3)在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其反应化学平衡常数和T的关系如下表所示:
CO(g)+H2O(g),其反应化学平衡常数和T的关系如下表所示:
T/℃ | 700 | 800 | 830 | 1000 | 1200[来 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
A.对于CO(g)+H2O(g)![]() CO2(g)+H2(g)此平衡体系,升温平衡向移动。
CO2(g)+H2(g)此平衡体系,升温平衡向移动。
B.达到平衡后,若压缩容器的体积,正逆反应速率的变化是。
C.对原平衡,在t0时升高温度对化学反应速率产生影响,请在下图中绘出速率变化图:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com