
【题目】下列图象分别表示有关反应的反应过能量变化的关系:据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
B. 白磷比红磷稳定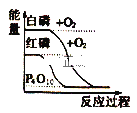
C. (g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2,则△H1>△H2
D. CO(g)+H2O(g)=CO2(g)+H2(g) △H>0
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是
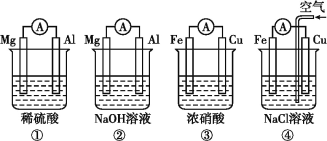
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,电极反应式为6H2O+6e6OH+3H2↑
C. ③中Fe作负极,电极反应式为Fe3eFe3+
D. ④中Cu作正极,电极反应式为2H++2eH2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近20年来,对以氢气作为未来的动力燃料氢能源的研究得到了迅速发展。像电一样,氢是一种需要依靠其他能源,如石油、煤、原子能等的能量来制取的“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为“一级能源”,如煤、石油、太阳能和原子能等。发展民用氢能源,首先必须制得廉价的氢气。
⑴氢气燃烧时耗氧量小,发热量大。已知热化学方程式为:
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
C(g)+O2(g)=CO2(g) △H=-393.5 kJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生的热量的比值是________(保留两位小数)。
⑵某些科学家对以下3个反化学反应很感兴趣:
①3FeCl2+4H2O=Fe3O4+6HCl+H2
②2Fe3O4+3Cl2+12HCl=6FeCl3+6H2O+O2
③6FeCl3=6FeCl2+3Cl2
科学家研究上述反应意义在于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:
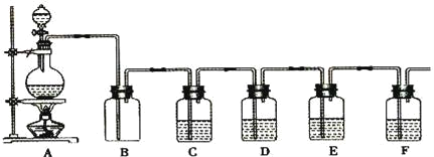
(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】117号元素Ts的原子最外层电子数是7,下列说法不正确的是
A.Ts是第七周期第ⅦA族元素B.还原性:I<Ts
C.原子半径:I<TsD.中子数为176的Ts的核素符号:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4—CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ·mol1,同时存在以下反应:积碳反应:CH4(g) C(s) +2H2(g) ΔH=+75 kJ·mol1;消碳反应:CO2(g) +C(s) 2CO(g) ΔH=+172 kJ·mol1,积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如下图。

下列说法正确的是
A.高压利于提高CH4的平衡转化率并减少积碳
B.增大CO2与CH4的物质的量之比有助于减少积碳
C.温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快,积碳量减少
D.升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值为1:1 ⑦混合气体总质量 ⑧混合气体总体积
A. ①②③④⑤⑥⑦⑧B. ①③④⑤C. ①②③④⑤⑦D. ①③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是
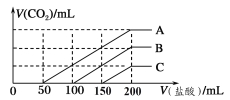
A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com