
【题目】117号元素Ts的原子最外层电子数是7,下列说法不正确的是
A.Ts是第七周期第ⅦA族元素B.还原性:I<Ts
C.原子半径:I<TsD.中子数为176的Ts的核素符号:![]()
【答案】D
【解析】
A.根据元素周期表的结构可知,118号元素为第七周期的零族元素,117号元素Ts的原子最外层电子数是7,Ts是第七周期第ⅦA族元素 ,故A正确;
B.Ts与I同主族,从上至下,随核电荷数增大,非金属性逐渐减弱,对应单质的氧化性逐渐减弱,其简单离子的还原性逐渐增强,则非金属性:Ts<I,还原性:I<Ts,故B正确;
C.Ts与I同主族,从上至下,随核电荷数增大,电子层数逐渐增多,原子半径逐渐增大,原子半径:I<Ts,故C正确;
D.根据原子序数=质子数,Ts的质子数为117,中子数为176,质量数=质子数+中子数=117+176=293,则Ts的核素符号:![]() ,故D错误;
,故D错误;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O===2LiOH+H2↑。电池工作时,下列说法错误的是( )

A. 金属锂作负极
B. 电子从锂电极经导线流向镍电极
C. 可将电能转化为化学能
D. 海水作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
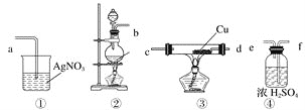
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O,相对分子质量为246]是一种重要的染料及农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一水硫酸四氨合铜晶体并测定其纯度。回答相关问题:
I.实验室制取CuSO4溶液
方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸即可得到硫酸铜溶液。
(1)请写出方案i反应的化学方程式____,其缺点是____(写1点)。
(2)实际生产中方案ii常常有紫红色固体未反应,猜想原因可能是____。
(3)基于此,实验进行了改进,其中一种方案是在硫酸和铜的反应容器中滴加H2O2溶液,观察到的现象是____(写1点)。H2O2的沸点为150.2℃。为加快反应需要提高H2O2溶液的浓度,可通过下图将H2O2稀溶液浓缩,冷水入口是____(填a或b),增加减压设备的目的是____。
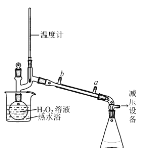
II.一水硫酸四氨合铜晶体的制备
(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式__________。
(5)继续滴加NH3·H2O,会转化成深蓝色溶液。从深蓝色溶液中析出深蓝色晶体的简便实验是滴加____________。
III.产品纯度的测定
(6)精确称取mg晶体,加适量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸气将氨全部蒸出,用V1mL0.200mol·L-1的盐酸完全吸收。以甲基橙作指示剂,用0.200mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。产品纯度的表达式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象分别表示有关反应的反应过能量变化的关系:据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
B. 白磷比红磷稳定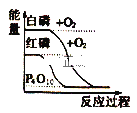
C. (g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2,则△H1>△H2
D. CO(g)+H2O(g)=CO2(g)+H2(g) △H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 2SO2 + O2![]() 2SO3 △H=-196.6 kJ·mol-1
2SO3 △H=-196.6 kJ·mol-1
B. C(s) + O2(g) = CO2(g) △H=393.5 kJ·mol-1
C. H+(aq) + OH-(aq) = H2O(l) △H=57.3 kJ
D. ![]() H2(g) +
H2(g) + ![]() Cl2(g) = HCl(g) △H=-92.5 kJ·mol-1
Cl2(g) = HCl(g) △H=-92.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
图Ⅰ 图Ⅱ
图Ⅱ
A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. 图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C. 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v正>v逆
D. 200 ℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A的体积分数等于0.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com