


科目:高中化学 来源: 题型:
| A、金属钠存放于煤油中 |
| B、硝酸贮存在避光、低温处 |
| C、氯水贮存在棕色瓶中,放在冷暗处 |
| D、烧碱溶液贮存在带玻璃塞的细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
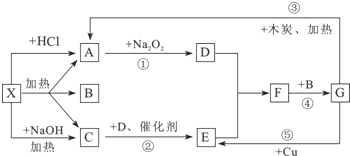
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+5 | B、+1 | C、-5 | D、-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸与氢氧化钡溶液反应:H++OH-=H2O |
| B、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| C、铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ |
| D、氯气与溴化钠溶液反应:Cl2+2Br-=Br2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3) |
| B、c(Na+)>c(CO32-)>c(H+)>c(OH-) |
| C、c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| D、c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com