
 以下为五种有机物的有关信息,根据表中信息回答问题.
以下为五种有机物的有关信息,根据表中信息回答问题.| A | B | D | E | F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶. | 其产量用来衡量一个国家的石油化工水平. | 比例模型为: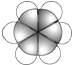 | ①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体. | 由5个原子组成的10个电子的共价分子. |
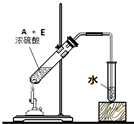
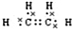 ,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)
,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)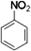 .
.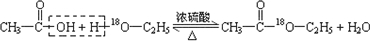 .
.分析 由信息可知,E可除水垢,在低于16.6℃时,凝固成冰一样的晶体,则E为乙酸,A和E在浓硫酸作用下发生反应,应为酯化反应,则A为乙醇;B的产量用来衡量一个国家的石油化工水平,B为乙烯;由D的比例模型可知,D为苯;F由5个原子组成的10个电子的共价分子,则F为甲烷.
(1)A中含-OH,结合醇的性质来解答;
(2)B中含碳碳双键,可与溴水发生加成反应;溴水的质量增加2.8g时,为乙烯的质量2.8g,以此计算;
(3)在浓硫酸作用下,苯和浓硝酸发生取代反应生成硝基苯;
(4)醇脱H,羧酸脱OH生成酯,图中不能使用酒精喷灯,缺少沸石、导管不能深入液面下,不能用水吸收;
解答 解:由信息可知,E可除水垢,发生酯化反应,则E为乙酸,则A为乙醇;B的产量用来衡量一个国家的石油化工水平,B为乙烯;由D的比例模型可知,D为苯;F由5个原子组成的10个电子的共价分子,则F为甲烷.
(1)A中含-OH,名称为羟基,
①乙醇无毒,故错误;
②乙醇为无色刺激性气味的液体,故错误;
③密度比水小,但与水混溶,故正确;
④与酸性高锰酸钾溶液发生氧化反应,使其褪色,故正确;
⑤乙醇与水混溶,则不能在海带提碘实验中作萃取剂从碘水中提取碘单质,故错误;
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物,乙醛,故正确;
故答案为:羟基;C;
(2)B为乙烯,其电子式为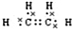 ,含碳碳双键,可与溴水发生加成反应;溴水的质量增加2.8g时,为乙烯的质量2.8g,则1,2-二溴乙烷的质量为2.8g+$\frac{2.8g}{28g/mol}$×160g/mol=18.8g,
,含碳碳双键,可与溴水发生加成反应;溴水的质量增加2.8g时,为乙烯的质量2.8g,则1,2-二溴乙烷的质量为2.8g+$\frac{2.8g}{28g/mol}$×160g/mol=18.8g,
故答案为: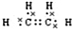 ;加成;18.8;
;加成;18.8;
(3)工业上,苯来源于煤干馏后的液态产物煤焦油,在浓硫酸作用下,苯和浓硝酸发生取代反应生成硝基苯,硝基苯的结构简式为 ,
,
故答案为:干馏; ;
;
(4)用18O标记的A与不含18O的E在一定条件下发生反应的化学方程式为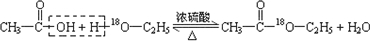 ,图中有4处错误,分别为不能使用酒精喷灯,温度太高;缺少沸石,不能防止暴沸;导管不能深入液面下,不能防止倒吸,不能用水吸收,应利用饱和碳酸钠溶液,
,图中有4处错误,分别为不能使用酒精喷灯,温度太高;缺少沸石,不能防止暴沸;导管不能深入液面下,不能防止倒吸,不能用水吸收,应利用饱和碳酸钠溶液,
故答案为: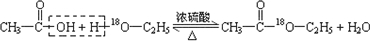 ;4
;4
点评 本题考查有机物的结构与性质,为高频考点,把握常见有机物的官能团及性质为解答的关键,注意利用表格信息推断物质为解答的突破口,侧重醇、羧酸、苯性质的考查,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 合成氨反应:N2(g)+3H2(g)?2NH3(g);△H<0,为使氨的产率提高,理论上应采取低温高压的措施 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | 已知反应2NO2(g)?N2O4(g),红棕色气体NO2加压后颜色先变深后变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系压强保持不变 | B. | 混合气体颜色保持不变 | ||
| C. | SO3和NO的体积比保持不变 | D. | 每消耗1molSO3的同时生成1molNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾是溶液,能永久在空气中稳定存在 | |
| B. | 雾的胶体,一段时间内能稳定存在 | |
| C. | 雾是乳浊液,不能稳定存在 | |
| D. | 雾的悬浊液,在空气中能沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com