

 ,其反应方程式为
,其反应方程式为 (不要求标出反应条件).
(不要求标出反应条件). (不要求标出反应条件).
(不要求标出反应条件).分析 (1)化合物Ⅰ中含有碳碳双键可C=N,可与氢气发生加成反应;
(2)原子利用率100%,为结成反应,可利用质量守恒定律推断分子式;
(3)化合物Ⅱ含有羟基,可发生取代反应,化合物Ⅲ含有碳碳双键,可发生加成、加聚、氧化反应;
(4)化合物Ⅲ含有碳碳双键,可发生加聚反应生成高聚物;
(5)从质量守恒的角度结合氧化剂的性质判断.
解答 解:(1)根据提供的产物可以写出其化学方程式为 ,
,
故答案为: ;
;
(2)根据“原子的利用率为100%”可知另一反应物的分子式为CH2O,
故答案为:CH2O;
(3)因化合物Ⅱ分子中含有醇羟基,所以可以和CH3COOH反应,也可以和金属钠反应放出H2,故A正确、B错误;在化合物Ⅲ的分子中含有C=C双键,故可以使溴的四氯化碳溶液褪色,也可以使高锰酸钾溶液褪色,故C正确、D错误,
故答案为:A、C;
(4)由化合物Ⅲ到化合物Ⅳ发生了加聚反应,其方程式应写为 ,
,
故答案为: ;
;
(5)从生成的克矽平的结构简式和生成的水,结合物质守恒定律,所选的氧化剂只能是含有氢和氧两种元素,即H2O2,故答案为:H2O2.
点评 本题考查有机物的合成,侧重于考查学生化学知识的综合运用能力,注意把握有机物的结构和官能团的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
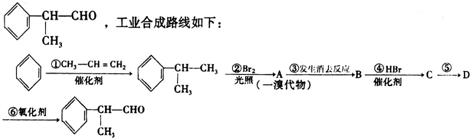
 或
或 .
. .
. +NaOH$→_{△}^{H_{2}O}$NaBr+
+NaOH$→_{△}^{H_{2}O}$NaBr+ ,其反应类型为取代反应.
,其反应类型为取代反应. (或
(或 ).
). 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中含有1 mol MgCl2 | |
| B. | Cl-浓度为2 mol•L-1 | |
| C. | 溶液中含有1 mol MgCl2 | |
| D. | 将95 g MgCl2溶于1 L水中所得的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水久置后黄绿色消失 | |
| B. | 淀粉溶液遇碘单质变蓝 | |
| C. | SO2使品红溶液褪色 | |
| D. | 溴水中加入CCl4溶液,振荡静置后,上层呈橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶吸附能力很强,常用作袋装食品、瓶装药品的干燥剂 | |
| B. | 氧化铝熔点很高,可用来制作耐火坩埚及耐高温实验仪器 | |
| C. | 二氧化硫能使品红溶液褪色,将氯气通入二氧化硫的饱和溶液中可增强其漂白性 | |
| D. | 硅导电性介于导体和绝缘体之间,是良好的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol O2和4mol NO2 | B. | 1mol O2和4mol NO | ||
| C. | 1mol NO和5mol NO2 | D. | 4mol NO和1mol NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com