
| A. | 1mol O2和4mol NO2 | B. | 1mol O2和4mol NO | ||
| C. | 1mol NO和5mol NO2 | D. | 4mol NO和1mol NO2 |
分析 二氧化氮和氧气和水反应方程式为4NO2+2H2O+O2=4HNO3,NO和氧气、水反应方程式为4NO+2H2O+3O2=4HNO3,硝酸能和氢氧化钠反应生成硝酸盐,根据方程式知NO+NO2+2NaOH═2NaNO2+H2O、2NO2+2NaOH═NaNO2+NaNO3+H2O,如果混合气体是氮氧化物,NO、NO2的物质的量之比>1:1,则NO有剩余,如果NO、NO2的物质的量之比≤1:1,则氮氧化物没有剩余,据此分析解答.
解答 解:A.二氧化氮和氧气和水反应方程式为4NO2+2H2O+O2=4HNO3,根据方程式知,二者恰好反应生成硝酸,硝酸和过量NaOH反应生成硝酸钠,所以氮氧化物能被完全吸收,故A不选;
B.一氧化氮和氧气和水反应方程式为4NO+2H2O+3O2=4HNO3,硝酸能和氢氧化钠反应生成硝酸钠,根据方程式知,NO有剩余,所以氮氧化物不能完全被吸收,故B选;
C.根据方程式知NO+NO2+2NaOH═2NaNO2+H2O2NO2+2NaOH═NaNO2+NaNO3+H2O知,NO、NO2的物质的量之比<1:1,氮氧化物完全被吸收,故C不选;
D.该混合气体是氮氧化物,根据NO+NO2+2NaOH═2NaNO2+H2O、2NO2+2NaOH═NaNO2+NaNO3+H2O知,NO、NO2的物质的量之比>1:1,所以氮氧化物不能完全被吸收,故D选;
故选BD.
点评 本题考查混合物的有关计算,明确氮氧化物和NaOH反应关系式是解本题关键,侧重考查学生分析判断能力,注意:单纯的NO和NaOH不反应,二氧化氮和NaOH反应,为易错点,题目难度中等.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题

 ,其反应方程式为
,其反应方程式为 (不要求标出反应条件).
(不要求标出反应条件). (不要求标出反应条件).
(不要求标出反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氯化钠是由钠离子和氯离子组成的化合物 | |
| B. | 氯化钠电离成钠离子和氯离子不需要通电 | |
| C. | 氯化钠的电离方程式为:NaCl═Na++Cl- | |
| D. | 水合钠离子和水合氯离子周围水分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅可用于制作光导纤维 | B. | 过氧化钠可作潜水艇中的供氧剂 | ||
| C. | 氢氟酸可用来刻蚀玻璃 | D. | 漂白粉可用作游泳池的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 1.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
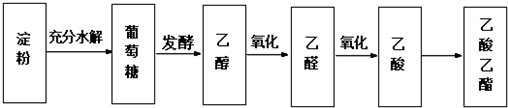
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com