
下列说法正确的是( )
A.室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷
B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3
D.油脂在酸性或碱性条件下均能发生水解反应,且产物相同
科目:高中化学 来源: 题型:
硫代硫酸钠 一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O).
I.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中能入SO2可制得Na2S2O3;所得产品常含有少量Na2SO3和Na2SO4.
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
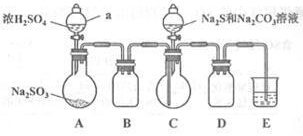 II.【制备产品】
II.【制备产品】
实验装置如图所示(省略夹持装置):
实验步骤:
(1)检查装置气密性,按图示加入试剂。
仪器a的名称是 ① ;E中的试剂是 ② (选填下列字母编号)。
A。稀H2SO4 B. NaOH溶液 C。饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4.
(3)等Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液 (填写操作名称)、结晶、过滤、洗涤、干燥,得到产品。
III.【探究与反思
(1)为验证产品 中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成, ,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4.
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是 。
(3)Na2S2O3·5H2O的溶液度随温度升高显著增大,所得产品通过 方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O3•5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾1碘的标准溶液滴定。
反应原理为:2S2O32‾+I2=S4O62-+2I‾
 (5)滴定至终点时,溶液颜色的变化: 。
(5)滴定至终点时,溶液颜色的变化: 。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O3•5H2O相对分子质量为M) 。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42‾,常用作脱氧剂,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
“心得安”是治疗心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略):
回答下列问题:
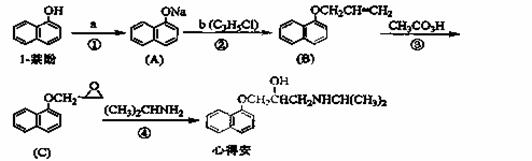
(1)试剂a是 ,试剂b的结构简式为 ,b中官能团的名称是 。
(2)③的反应类型是 。
(3)心得安的分子式为 。
(4)试剂b可由丙烷经三步反应合成:
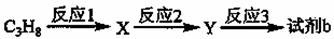
反应1的试剂与条件为 ,
反应2的化学方程式为 ,
反应3的反应类型是 。(其他合理答案也给分)
(5)芳香化合物D是1-萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E( C2H4O2) 和芳香化合物F (C8H6O4),E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。D的结构简式为 ;
由F生成一硝化产物的化学方程式为 ,
该产物的名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下x克钢样中碳、硫转化为CO2、SO2。

 ①气体a的成分是____________________。
①气体a的成分是____________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5 O2 1_________+3___________。
1_________+3___________。
(2)将气体a通入测硫酸装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:_________________。
②用NaOH溶液滴定生成的H2SO4,消耗zmLNaOH溶液,若消耗1mLNaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:_________________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。

①气体a通过B和C的目的是_____________________。
②计算钢样中碳的质量分数,应测量的数据是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素R、T、Q、W在元素周期表中的相对位置如右图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
短周期元素R、T、Q、W在元素周期表中的相对位置如右图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
( )
A.最简单气态氢化物的热稳定性:R > Q
B.最高价氧化物对应水化物的酸性:Q < W
C.原子半径:T>Q>R
D.含T的盐溶液一定 显酸性
显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
| 族 周期 | I A | ⅡA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ |
| |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)11种元素中,化学性质最不活泼的是 。
(2)①②⑤⑥⑧中,最高价氧化物的水化物中碱性最强的是 酸性最强的是
(3)②③④中形成的简单离子半径由大到小的顺序是 。⑧⑨ 三种元素形成的气态氢化物最稳定的是 。
三种元素形成的气态氢化物最稳定的是 。
(4)元素①与⑦形成个数比l:1化合物的电子式为: ,该化合物灼烧时焰色 为 ,该化合物常温下和元素⑦的氢化物反应的离子方程式是 。
(5)写出单质⑤和元素①的最高价氧化物对应的水化物相互反应的化学方程式:
。
(6) ③和⑧两元素可形成 (填“离子键”或“共价键”),写出其形成过程:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com