
 、
、 、
、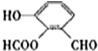 ..
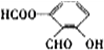
.. 分析 ①分子式为C8H604,该分子不饱和度=$\frac{8×2+2-6}{2}$=6,苯环的不饱和度为4;
②含有苯环结构,且苯环上相邻的三个碳原子上都连有取代基,即有3个取代基处于邻位;
③该同分异构体能发生银镜反应,说明含有醛基;
④遇到FeCl3溶液显紫色,说明含有酚羟基;
⑤能与热氢氧化钠溶液反应,1mol有机物消耗3molNaOH,1个酚羟基消耗1个NaOH,醛基能与氢氧化钠不反应,所以分子中含有酯基,据此书写符合条件的同分异构体结构简式.
解答 解:根据该同分异构体在一定条件下能发生银镜反应和水解反应,遇到FeCl3溶液显紫色,说明含有酚羟基、醛基、酯基,在由于苯环上相邻的三个碳原子上都连有取代基,则同分异构体的结构简式为: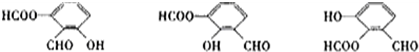 ;
;
故答案为: 、
、 、
、 .
.
点评 本题考查同分异构体书写,明确官能团及其性质关系是解本题关键,同分异构体的书写是学习难点,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,将浓度均为0.10mol.L-1、体积均为V0L的HX溶液和HY溶液分别加水稀释至体积为VL,其AG[AG=lg$\frac{c{(H}^{+})}{c{(OH}^{-})}$]随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
常温下,将浓度均为0.10mol.L-1、体积均为V0L的HX溶液和HY溶液分别加水稀释至体积为VL,其AG[AG=lg$\frac{c{(H}^{+})}{c{(OH}^{-})}$]随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )| A. | HX的酸性强于HY的酸性 | |
| B. | a点的c(Y-)与b点的c(X-)相等 | |
| C. | 水的电离程度:a点小于c点 | |
| D. | 若两溶液同时升高温度,则c(Y-)和c(X-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液的pH=7 | |
| B. | 把镁粉加入FeCl3饱和溶液中,有气体和红褐色沉淀生成 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液蒸干的方法 | |
| D. | 盐类水解反应的逆反应是酸碱中和反应,但酸碱中和反应不一定是可逆反应. |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
据报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程如下图所示。下列说法中不正确的是 ( )

A.状态I→状态Ⅲ是放热过程
B.该过程中,CO没有断键形成C和O
C.状态I→状态Ⅲ表示CO和O生成了CO2
D.状态I→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com