
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+与R2-的核外电子数相等 B.M与T形成的化合物具有两性
C.氢化物的稳定性为H2T<H2R D.单质与浓度相等的稀盐酸反应的速率为L<Q
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
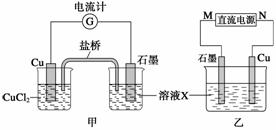
①图中X溶液是_____________________________;
②石墨电极上发生的电极反应式为__________________________________________;
③原电池工作时,盐桥中的____________(填“K+”或“Cl-”)不断进入X溶液中。
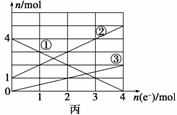
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是__________极; ②图丙中的②线是______________的变化。
③当电子转移为2 mol时,向乙烧杯中加入________ L 5 mol·L-1 NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O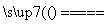 Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入250mL 4mol/L的稀硝酸,恰好使混合物完全溶解。放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.21mol B.0.25mol C.0.45mol D.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
用二氧化氯、铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术,ClO2和Na2FeO4在水处理过程中分别被还原为Cl﹣和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 ▲ > ▲ > ▲
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 ▲
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O
①写出第二步反应的离子方程式 ▲
②工业生产时需在反应物中加少量Cl﹣,其作用是 ▲
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为﹣59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得,ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
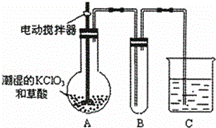
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置 ▲
②C中应装的试剂为 ▲ C中发生反应的化学方程式为: ▲
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是
A.XY2 B.X2Y3 C.X3Y2 D.X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
I、按下图装置,持续通入气态物质X,可以看到a处有红色物质生成,b处变蓝,c处得到无色液体可用于其它实验。
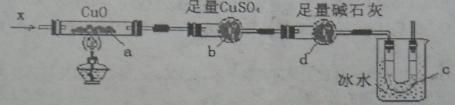
①X可能是 (从所给物质中选取,填代号)
A.H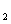 B.CH3CH2OH(g) C.NH3 D.CO和H2
B.CH3CH2OH(g) C.NH3 D.CO和H2
写出在a中所进行反应的反应方式 。
②实验中C处U型管浸没在冰水中,使用冰水的目的是: 。
③该实验装置有一明显缺陷,请指出: 。
Ⅱ、某同学偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
查看答案和解析>>
科目:高中化学 来源: 题型:
所谓“绿色汽车”是指使用液化石油气作能源的汽车。绿色汽车可避免有毒的铅、苯的同系物以及稠环芳烃的排放。燃烧等质量的液化石油气(主要成分是含C3—C4的烷烃烃)与汽油(主要成分是含C5—C11的烷烃烃)相比较
A. 液化石油气生成的水少 B. 液化石油气消耗氧气量少
C. 液化石油气燃烧产生的热量少 D. 液化石油气产生的含碳化合物少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com