
| A.H2S | B.SO2 | C.H2SO3 | D.H2SO4 |
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:不详 题型:单选题
| A.KCl为还原产物 | B.HCl全部发生氧化反应 |
| C.该反应表明氧化性KClO3比Cl2强 | D.1mol KClO3在反应中得到6mole- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.脱水性; | B.强酸性; | C.二元酸; | D.强氧化性 E. 吸水性 |
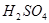 的干燥器中,过一段时间胆矾变白色
的干燥器中,过一段时间胆矾变白色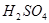 反应,可生成
反应,可生成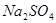 和
和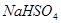 这两种盐
这两种盐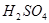 变黑
变黑 中放入铝片就产生NO
中放入铝片就产生NO查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe(OH)3既是氧化产物又是还原产物 |
| B.氧气是氧化产物 |
| C.做氧化剂的过氧化钠和做还原剂的过氧化钠物质的量之比为3:1 |
| D.过氧化钠只做氧化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S02和Cl2都能使品红溶液褪色,且加热后均恢复原色 |
| B.Si02是酸性氧化物,能与NaOH溶液反应 |
| C.高温时,CuO比Cu2O稳定 |
| D.将铜片放入浓硫酸中,无明显现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应中Fe2+是还原剂,O2是还原产物 |
| B.4 mol Na2O2在反应中共得到8NA个电子 |
| C.Fe(OH)3是氧化产物,每生成1 mol O2反应过程中共转移6 mol电子 |
| D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
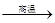 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2 +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com