
【题目】某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2;②Cl2;③CH4;④HCl;⑤NH3;⑥NO;⑦NO2;⑧SO2,下列操作正确的是
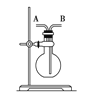
A.烧瓶是干燥的,由A进气收集①③⑤
B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C.在烧瓶中充满水,由A进气收集①③⑤⑦
D.在烧瓶中充满水,由B进气收集⑥
科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
⑴下列“鲜花保鲜剂”的成分中,属于非电解质的是 。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
⑵“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol.L-1。(只要求写表达式,不需要计算)
⑶配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、 、 。(在横线上填写所缺仪器的名称)
⑷在溶液配制过程中,下列操作正确且对配制结果没有影响的是 。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:

请回答有关问题:
(1)甲方案:为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H 2SO 4 ):n(HNO 3 )= 。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L -1的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO 4·5H 2O 20.0g【已知有关摩尔质量:M(CuSO4·5H 2O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H 2O的产率为 。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
反应中加入少量FeSO4 可加速铜的氧化,FeSO4 的作用是 ;
反应过程中的的离子方程式为: 、 。
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条): 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少环境污染,某工厂生产玻璃与处理窑炉气的工艺流程如下:
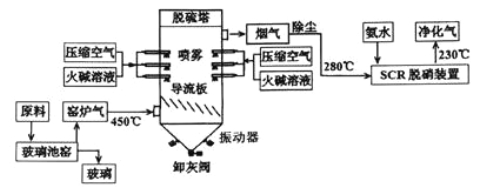
(1)生产普通玻璃、普通硅酸盐水泥和高炉炼铁都要用到的原料是________(填化学式),该物质在制玻璃过程中参与的化学方程式是_______________。
(2)生产玻璃中产生的窑炉气除SO2和氮氧化物外主要还有_________。
(3)窑炉气中的SO2一部分来源于原料中添加剂Na2SO4的热分解,该反应方程式为___________;
(4)在“脱硫塔”中喷洒火碱而不用石灰水的原因是___________;在进入“SCR脱硝装置”的烟气要先除尘的原因是_________________。
(5)烟气脱硝可采用氨水(NH3·H2O)脱除烟气的NO,其原理如图:

该脱硝原理中,NO最终转化为____________(填化学式)。当消耗1molNH3和0.25molO2时,除去的NO在标准状况下的体积为_____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法正确的是
A. 一定条件下能发生取代反应 B. 能与溴水反应而褪色
C. 苯环的碳原子间存在单双键交替结构 D. 苯不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、烧碱在工农业生产和工业废水处理中具有广泛用途。回答下列问题:
(1)工业上制取硝酸的第一步是以氨和空气为原料,用铂一铑合金网为催化剂,在氧化炉中(温度为800℃)进行氨催化氧化反应。该反应的氧化产物为____________(填名称)。
(2)某工业废水中含有2Mg2+、Cu2+等离子。取一定量的该工业废水,向其中滴加烧碱溶液,当Mg(OH)2开始沉淀时,溶液中![]() 为____________。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
为____________。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
(3)已知反应N2(g)+3H2(g)![]() 2NH3(g)的△H=-92.2kJ/mol,1molN2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6KJ、436KJ的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为__________KJ。
2NH3(g)的△H=-92.2kJ/mol,1molN2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6KJ、436KJ的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为__________KJ。
(4)Fritz Haber 研究了下列反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:

①在0~10min内,平均反应速率v(NH3)= ___________。
②在10~20min内,各物质浓度变化的原因可能是_________(填“加了催化剂”或“降低温度”),其判断理由是________________。
③温度和密闭容器的容积一定时,当容器内的总压强不再随时间而变化,反应是否达到了化学平衡状态?___________(填“是”或“否”)其判断理由是_________________。
④500℃时,该反应的平衡常数K的计算式为_________(不需要算出结果,) NH3的体积分数是_________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列3种物质:①苯、②乙醇、③乙酸中,常用于皮肤消毒的是_______(填序号,下同);可用来萃取碘水中的碘的是_______;可与NaHCO3溶液反应产生气体的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产重铬酸钾。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图所示。反应器中涉及的主要反应是:6 FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐。写出氧化铝与碳酸钠反应的化学方程式:______________________。
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:_________________。
(3)步骤③中测定pH值的操作为:________________。
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
操作步骤 | 实验现象 | 结论 |
①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置。 | 试管中仍有固体物质 | 固体为_____________ |
②操作①后,过滤;在滤液中加入过量的____________。 | 有红褐色沉淀产生 | 沉淀为Fe (OH)3 |
③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2。 | _____________ | 生成物为Al (OH)3; |
(5)称取重铬酸钾(其式量为294)试样2.5000 9配成250 mL溶液,用移液管取出25. 00 mL于碘量瓶中,加入10 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需________和________________。
②若实验中共用去Na2S2O3标准溶液40. 00 mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)____________。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学等多个领域潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是
3Fe2++2S2O32-+O2+xOH-![]() Fe3O4↓+S4O62-+2H2O。
Fe3O4↓+S4O62-+2H2O。
请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是_________________,S2O32-中S的化合价为________________.
(2)反应的化学方程式中![]() =_________.
=_________.
(3)每生成 1mol Fe3O4,反应转移的电子为__________mol,被Fe2+还原的O2的物质的量为__________mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com