
【题目】下表为元素周期表的一部分用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:________。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为_______________,第三周期中除⑩元素以外离子半径最小的是_________(填离子符号)。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为______________。在反应后的溶液中加入有机溶剂四氯化碳(CCl4),振荡后静置的实验现象为_______________。
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式________;④⑧⑨元素的离子的还原性由强到弱顺序为____________(用离子符号)。
【答案】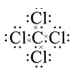 NH3+HNO3=NH4NO3 Al3+ KOH H-O-H 2H2O+2F2=4HF+O2 Cl2+2Br-=Br2+2Cl- 液体分层,上层无色,下层呈橙红色
NH3+HNO3=NH4NO3 Al3+ KOH H-O-H 2H2O+2F2=4HF+O2 Cl2+2Br-=Br2+2Cl- 液体分层,上层无色,下层呈橙红色 ![]() Br->Cl->F-
Br->Cl->F-
【解析】
根据元素在周期表的位置,可确定从①--⑩号元素分别是N、K、Mg、F、Al、C、O、Cl、Br、Ar。然后根据元素周期表与元素周期律的关系分析解答。
(1)⑥与⑧元素组成的分子是CCl4,C原子最外层有4个电子,Cl原子最外层有7个电子,C原子与4个Cl原子形成4个共价键,从而使分子中的每个原子都达到8个电子的稳定结构,所以CCl4的电子式是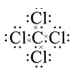 ;
;
(2)①是N元素,其气态氢化物NH3与其最高价氧化物水化物HNO3发生反应生成NH4NO3,反应的方程式为NH3+HNO3=NH4NO3;
在同一周期的元素中,金属元素的原子失去最外层电子,变为上周期惰性气体原子的稳定结构,而非金属原子获得电子变为本周期惰性气体元素的原子的稳定结构;对于电子层结构相同的离子,核电荷数越大,离子半径越小,所以第三周期中除⑩元素以外离子半径最小的是Al3+;
(3)②③⑤三种元素分别是K、Mg、Al,元素的金属性越强,其相应的最高价氧化物电源的水化物的碱性越强,由于元素的金属性K>Mg>Al,所以这三种元素的最高价氧化物对应的水化物的碱性:KOH>Mg(OH)2>Al(OH)3,所以碱性最强的是KOH,元素⑦是O元素,其氢化物是H2O,O原子与2个H原子形成2个共价键,所以水的结构式为H-O-H;该氢化物和元素④单质F2发生反应,产生HF和O2,反应的化学方程式为2H2O+2F2=4HF+O2。
(4)元素⑧的单质是Cl2与②⑨形成的化合物KBr会发生置换反应,产生KCl和Br2,反应的离子方程式为Cl2+2Br-=Br2+2Cl-。在反应后的溶液中加入有机溶剂四氯化碳(CCl4),由于Br2容易溶于四氯化碳,而四氯化碳与水互不相容,密度比水大,所以振荡后静置,观察到的现象是液体分层,上层无色,下层呈橙红色。
(5)与②同主族,第三周期的元素单质是Na,在⑦的单质O2中燃烧生成的化合物是Na2O2,该化合物是离子化合物,其电子式是![]() ;④⑧⑨元素是F、Cl、Br,三种元素在周期表中位于同一主族,由于从上到下原子半径逐渐增大,所以三种元素的离子的还原性逐渐增强,因此三种元素的离子的还原性由强到弱顺序为Br->Cl->F-。
;④⑧⑨元素是F、Cl、Br,三种元素在周期表中位于同一主族,由于从上到下原子半径逐渐增大,所以三种元素的离子的还原性逐渐增强,因此三种元素的离子的还原性由强到弱顺序为Br->Cl->F-。


科目:高中化学 来源: 题型:
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是( )
的叙述错误的是( )
A. 原子序数116B. 中子数177
C. 核外电子数116D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00 mL 0.049 mol·L-1羟胺的酸性溶液与足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.55 mL 0.020 mol·L-1酸性KMnO4溶液完全反应。已知(未配平):FeSO4+KMnO4+H2SO4 → Fe2(SO4)+K2SO4+MnSO4+H2O,则羟胺的氧化产物是
A. N2 B. N2O C. NO D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫、氮气、二氧化碳组成的混合气体在同温、同压下与笑气(N 2O)的密度相同,则该 混合气体中二氧化硫、氮气、二氧化碳的质量比为( )
A. 4:5:6 B. 22:1:14
C. 64:35:13 D. 29:8:13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2 。关于该装置的下列说法正确的是

A.图中N型半导体为正极,P型半导体为负极
B.图中离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的碱性增强
D.人体呼出的气体参与X电极的反应:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Fe、H2、Ba(OH)2溶液,K2CO3溶液,NaOH溶液,稀硫酸等六种物质,在常温下两种物质间能发生的化学反应最多有
A. 4个 B. 5个 C. 6个 D. 7个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_________________。(填化学式)
(2)在合成塔中,若有4400g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,该反应的热化学方程式为_________________。
(3)一定条件下,往2 L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是_________________(填“反应I”、“反应II”、“反应III”)。同一种催化剂,温度越高,催化效果_________________(填“不变”、“增强”、“减弱”),分析其原因可能是_________________(填字母)。
A.温度升高,平衡逆向移动 B.温度升高,催化剂失活
C.温度升高,催化剂脱附率增加 D.温度升高,平衡常数减小
②b点v(正)________v(逆)(填“>”、“<”或“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________________。
④c点时该反应的平衡常数K=_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com