
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_________________。(填化学式)
(2)在合成塔中,若有4400g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,该反应的热化学方程式为_________________。
(3)一定条件下,往2 L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是_________________(填“反应I”、“反应II”、“反应III”)。同一种催化剂,温度越高,催化效果_________________(填“不变”、“增强”、“减弱”),分析其原因可能是_________________(填字母)。
A.温度升高,平衡逆向移动 B.温度升高,催化剂失活
C.温度升高,催化剂脱附率增加 D.温度升高,平衡常数减小
②b点v(正)________v(逆)(填“>”、“<”或“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________________。
④c点时该反应的平衡常数K=_________________。
【答案】KHCO3 CO2(g)+3H2(g) = H2O(g)+CH3OH(g) ΔH=-53.7 kJ/mol 反应I 减弱 BC > 该反应正反应方向为放热反应,温度升高,平衡逆向移动,转化率降低 5.33 L2mol-2
【解析】
(1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3,KHCO3在分解池中分解生成二氧化碳;
(2)首先算出1mol二氧化碳反应放出的热量,再书写热化学方程式;
(3)①由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率;②T3的b点时,反应未达到限度;③该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,使CO2的转化率降低;④根据三段式计算出平衡时各种物质的浓度,再根据平衡常数表达式计算。
(1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3,KHCO3在分解池中分解生成二氧化碳,因此分解池中主要物质为KHCO3,故答案为:KHCO3;
(2)1mol二氧化碳反应放出热量为5370kJ×![]() =53.7kJ,该反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-53.7kJ/mol,故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-53.7kJ/mol;
=53.7kJ,该反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-53.7kJ/mol,故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-53.7kJ/mol;
(3)①由图像知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,催化剂效果最佳的反应是反应Ⅰ;根据图像,同一种催化剂,温度越高,催化效果减弱,原因可能为:A.催化剂不改变平衡的移动,错误;B.温度升高,催化剂失活,使得催化效果减弱,正确;
C.温度升高,催化剂脱附率增加,使得催化效果减弱,正确;D.催化剂不改变平衡的移动,不能改变平衡常数,错误;故选BC,故答案为:反应Ⅰ;减弱;BC;
②T3的b点时,未达到反应限度,反应继续正向进行,故v(正)>v(逆),故答案为:>;
③该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低。T4的a点转化率比T5的c点高,故答案为:该反应为放热反应,温度升高,平衡逆向移动,转化率降低;
④c点时, CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
起始(mol/L): 0.5 1.5 0 0
转化(mol/L):0.5×![]() 0.5×
0.5×![]() ×3 0.5×
×3 0.5×![]() 0.5×
0.5×![]()
平衡(mol/L): ![]() 0.5
0.5 ![]()
![]()
在温度为T5时,该反应的平衡常数K=![]() =
=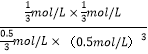 =
=![]() L2mol-2=5.33 L2mol-2,故答案为:
L2mol-2=5.33 L2mol-2,故答案为:![]() L2mol-2(或5.33 L2mol-2)。
L2mol-2(或5.33 L2mol-2)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:________。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为_______________,第三周期中除⑩元素以外离子半径最小的是_________(填离子符号)。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为______________。在反应后的溶液中加入有机溶剂四氯化碳(CCl4),振荡后静置的实验现象为_______________。
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式________;④⑧⑨元素的离子的还原性由强到弱顺序为____________(用离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件):X+Y=Z+W。
(1)若W能使带火星的木条复燃,Z可用于雕刻玻璃的化学反应方程式为:________________。
(2)若W是一种常见的半导体材料且X、W同主族,则Z的名称为:____________。
(3)若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则该反应的化学方程式是:_____。
(4)若X位于周期表的第IIA族,Z可作为耐火材料,则Y的电子式为_______,其属于含有_____(填“极性”、“非极性”)共价键的分子。
(5)若为铝热反应,下列能代替KClO3和镁带而引发铝热反应的是(_____)
A、直接用酒精灯加热 B、KMnO4、铝条 C、火柴头、浓盐酸 D、KMnO4、鞭炮引线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国康奈尔大学的研究人员提出的可呼吸二氧化碳电池入选美国2016年十大创新术。 电池的工作原理如图所示。下列说法不正确的是( )
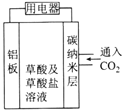
A. 该装置可将化学能转变成电能
B. 正极的电极反应式为2CO2+2e-=C2O42-
C. 利用该装置不但可减少CO2的排放,还可利用二氧化碳资源
D. 该装置中的两电极材料均被消耗,需定期补充、更换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R—![]() —
—![]()
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是_______________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②____________________________。
(3)B在苯环上的二氯代物有 种同分异构体。
(4)有机物 的所有原子 (填“是”或“不是”)在同一平面上。
的所有原子 (填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 0.5 mol·L-1硫酸溶液中逐滴加入烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的说法错误的是
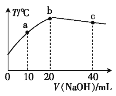
A. b点之前温度升高是因为发生了放热反应
B. bc段温度降低是因为与外界发生了热交换
C. c(NaOH)=0.5 mol·L-1
D. b点时酸碱恰好反应完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性条件下,KMnO4与H2C2O4发生氧化还原反应,用0.1 mol·L1的KMnO4与过量的H2C2O4反应,测得Mn2+的生成速率v与时间t的趋势如图,下列说法正确的是( )

A. 该反应中每生成1 mol CO2转移电子为10 mol
B. 方程式配平后,H2O的系数为6
C. 反应开始很短一段时间内v减小是因为反应物浓度减小,后来突然增大是因为生成的Mn2+对该反应有催化作用
D. t0时,Mn2+的浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示。

(1)从反应开始到10 s,用Z表示的反应速率为______________,X的物质的量浓度减少了______________,Y的转化率为____________。
(2)该反应的化学方程式为__________________________________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是________。

A.t1时刻,减小了Z的浓度 B.t1时刻,降低了体系温度
C.t1时刻,增大了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com