
【题目】向20 mL 0.5 mol·L-1硫酸溶液中逐滴加入烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的说法错误的是
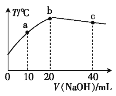
A. b点之前温度升高是因为发生了放热反应
B. bc段温度降低是因为与外界发生了热交换
C. c(NaOH)=0.5 mol·L-1
D. b点时酸碱恰好反应完全
【答案】C
【解析】
酸碱反应是放热反应,温度最高点(b)是酸碱恰好完全反应的点。
A.由分析可知,温度最高点(b)是酸碱恰好完全反应的点,b点之前发生酸碱中和反应,是放热反应,温度升高,故A正确;
B. 由分析可知,温度最高点(b)是酸碱恰好完全反应的点,bc段温度降低是因为与外界发生了热交换,故B正确;
C.由化学方程式H2SO4+ 2NaOH=Na2SO4+2H2O且b点时酸碱恰好反应完全可知,n(NaOH)=2n(H2SO4),即c(NaOH)V(NaOH)= 2c(H2SO4)V(H2SO4),代入数据计算c(NaOH)=![]() =1 mol·L-1,故C正确;
=1 mol·L-1,故C正确;
D. 温度最高点(b)是酸碱恰好完全反应的点,故D正确;
答案选C。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】二氧化硫、氮气、二氧化碳组成的混合气体在同温、同压下与笑气(N 2O)的密度相同,则该 混合气体中二氧化硫、氮气、二氧化碳的质量比为( )
A. 4:5:6 B. 22:1:14
C. 64:35:13 D. 29:8:13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分 CuFeS2)制取 FeSO4·7H2O 和Cu的主要流程如下:

(1)检验酸浸过程中 Fe2+是否被氧化,应选择________(填字母编号)。
A.KMnO4 溶液 B.K3[Fe(CN)6]溶液 C.KSCN 溶液
(2)酸浸过程中主要反应的化学方程式为__________。
(3)某同学向盛有 H2O2 溶液的试管中加入几滴酸化的 FeSO4 溶液,溶液变成棕黄色,发生反应的离子方程式为___________。一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成;产生气泡的原因是_________,生成沉淀的原因是___________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种重要的化工原料,但较易变质。
(1)实验室中欲检验Na2SO3固体样品是否已经变质,最简单的方法为_________________。
(2)某小组同学欲在实验室测定某Na2SO3样品的纯度。
方案一:通过测定生成SO2的质量,可计算mg Na2SO3固体样品的纯度。利用下列装置进行实验。
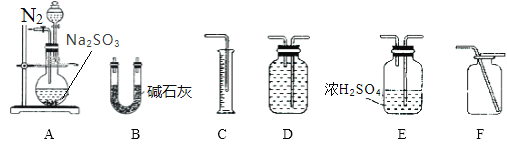
①选择装置A和B进行实验时,为使结果更精确还应选择装置_________________,装置A中反应前后通入N2的目的是_________________。
②实验结束后,若测得B装置增重了m1g,则该Na2SO3固体样品的纯度为__________。
方案二:利用高锰酸钾溶液滴定亚硫酸钠溶液,实现定量测定。称取a g样品,置于烧杯中;加入适量蒸馏水,使样品溶解,然后配制成250 mL溶液;准确量取25.00 mL溶液置于锥形瓶中;用0. 1 000mol/L的酸性KMnO4溶液进行滴定,经多次滴定,达到滴定终点时,平均消耗20.00 mL溶液。
③反应原理为(用离子方程式表示)_________________。
④滴定时,通常不需要加入指示剂,理由是_________________;达到滴定终点读取数据时,若俯视液面,则测定结果_________________(填“偏高”、“偏低”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_________________。(填化学式)
(2)在合成塔中,若有4400g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,该反应的热化学方程式为_________________。
(3)一定条件下,往2 L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是_________________(填“反应I”、“反应II”、“反应III”)。同一种催化剂,温度越高,催化效果_________________(填“不变”、“增强”、“减弱”),分析其原因可能是_________________(填字母)。
A.温度升高,平衡逆向移动 B.温度升高,催化剂失活
C.温度升高,催化剂脱附率增加 D.温度升高,平衡常数减小
②b点v(正)________v(逆)(填“>”、“<”或“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________________。
④c点时该反应的平衡常数K=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 氢气的摩尔质量是2g/mol B. 摩尔是物质的量的单位
C. 1molOH—的质量是17g D. 1mol气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅丹(Pb3O4)可作防锈用涂料,已知铅丹中Pb元素的化合价只有+2、+4,且+2价稳定,+4价的Pb具有强氧化性,能氧化浓盐酸生成Cl2。则下列说法不正确的是
A. Pb3O4可表示为2PbO·PbO2
B. 可用PbO在空气中加热制备铅丹,其n(氧化剂)∶n(还原剂)=1:2
C. 0.1mol Pb3O4与足量的浓盐酸反应,生成Cl2 0.1mol
D. a mol Pb3O4加强热分解生成PbO,则加热过程中转移电子数为3a NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成化合物的化学式最可能表示为( )
A.B3A2B.BA2
C.A3B2D.AB2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com