
����Ŀ��Na2SO3��һ����Ҫ�Ļ���ԭ�ϣ������ױ��ʡ�
(1)ʵ������������Na2SO3������Ʒ�Ƿ��Ѿ����ʣ���ķ���Ϊ_________________��
(2)ijС��ͬѧ����ʵ���ҲⶨijNa2SO3��Ʒ�Ĵ��ȡ�
����һ��ͨ���ⶨ����SO2���������ɼ���mg Na2SO3������Ʒ�Ĵ��ȡ���������װ�ý���ʵ�顣
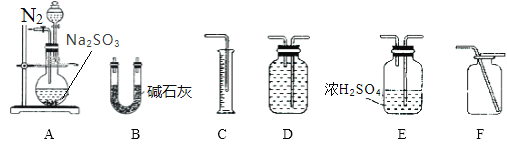
��ѡ��װ��A��B����ʵ��ʱ��Ϊʹ�������ȷ��Ӧѡ��װ��_________________��װ��A�з�Ӧǰ��ͨ��N2��Ŀ����_________________��
��ʵ������������Bװ��������m1g�����Na2SO3������Ʒ�Ĵ���Ϊ__________��
�����������ø��������Һ�ζ�����������Һ��ʵ�ֶ����ⶨ����ȡa g��Ʒ�������ձ��У�������������ˮ��ʹ��Ʒ�ܽ⣬Ȼ�����Ƴ�250 mL��Һ��ȷ��ȡ25.00 mL��Һ������ƿ�У���0. 1 000mol/L������KMnO4��Һ���еζ�������εζ����ﵽ�ζ��յ�ʱ��ƽ������20.00 mL��Һ��
�۷�Ӧԭ��Ϊ(�����ӷ���ʽ��ʾ)_________________��
�ܵζ�ʱ��ͨ������Ҫ����ָʾ����������_________________���ﵽ�ζ��յ��ȡ����ʱ��������Һ�棬��ⶨ���_________________(����ƫ��������ƫ����������Ӱ����)��
���𰸡�ȡ������Ʒ�ܽ����ȼ�����ϡ�������ټ�BaCl2��Һ�������ɰ�ɫ������֤��Na2SO3���������ް�ɫ����������֤��Na2SO3δ����(���ȼ�����BaCl2��Һ���ټ�����ϡ���ᣬ����ɫ��������ȫ�ܽ⣬֤��Na2SO3����������ɫ������ȫ�ܽ���֤��Na2SO3δ���� E ��Ӧǰ�ž�װ���еĿ�������Ӧ��װ���е�SO2ȫ������ ( 63m1/32m )��100�� 6H++ 5SO32��+2MnO4��=2Mn2++5SO42��+3H2O KMnO4��������ָʾ�������ﵽ��Ӧ�յ�ʱ������һ��KMnO4��Һ������ʹ��Һ����������ɫ�仯������ָʾ�յ� ƫ��
��������
(1)Na2SO3������Ʒ�Ѿ����ʣ�˵��������������ӣ�������������ӵļ��鷽�������
(2)�ٷ���һ������װ��AB�ⶨijNa2SO3��Ʒ�Ĵ��ȵ�ԭ��Ϊ����Ʒ��Ũ���ᷴӦ���ɶ�����������ͨ��Ũ�����������װ��B����ʯ�����գ��ⶨ���صö��������������ݴ˷�����𣻢ڶ������������Ϊm1g������H2SO4(Ũ)+Na2SO3=Na2SO4+SO2��+H2O���㴿�ȣ��۸��������Һ�ܹ���������������Һ����Ӧ���������̣������ƺ�����أ�д����Ӧ�����ӷ���ʽ���ܸ��������Һ����ɫ����Ӧ����Һ��ɫ����Һ��ɫ�����仯������c(����)=![]() �����ж���
�������
(1)Na2SO3������Ʒ�Ѿ����ʣ�˵��������������ӣ�����ȡ������Ʒ�ܽ⣬�ȼ�����ϡ���ᣬ�ټ�BaCl2��Һ����ַ�Ӧ�����а�ɫ�������ɣ�֤��Na2SO3�Ѿ����ʣ����ް�ɫ������֤��Na2SO3δ���ʣ��ʴ�Ϊ��ȡ������Ʒ�ܽ⣬�ȼ�����ϡ���ᣬ�ټ�BaCl2��Һ����ַ�Ӧ�����а�ɫ�������ڣ�֤��Na2SO3�Ѿ����ʣ����ް�ɫ������֤��Na2SO3δ���ʣ�
(2)������װ��AB�ⶨijNa2SO3��Ʒ�Ĵ��ȵ�ԭ��Ϊ����Ʒ��Ũ���ᷴӦ���ɶ�����������ͨ��Ũ�����������װ��B����ʯ�����գ��ⶨ���صö���������������˶���������Ҫ�������װ��ѡ��E�������ܳ����̳��������Ԫ���غ���㴿�ȣ�Ϊ��ֹװ���ڿ����еĶ�����̼��ˮ�������Ųⶨ����Ҫ��ʼͨ�������ž�װ���ڿ�������Ӧ����ͨ���������ɵĶ�������ȫ�������ʯ�����գ��ʴ�Ϊ��E����Ӧǰ�ž�װ���еĿ�������Ӧ��װ���е�SO2ȫ��������
�ڶ������������Ϊm1g������H2SO4(Ũ)+Na2SO3=Na2SO4+SO2��+H2O��֪��Na2SO3������Ϊm1g��![]() =
=![]() g����Na2SO3������Ʒ�Ĵ���=
g����Na2SO3������Ʒ�Ĵ���=![]() ��100%=
��100%=![]() ��100�����ʴ�Ϊ��
��100�����ʴ�Ϊ��![]() ��100����
��100����
�۸��������Һ�ܹ���������������Һ����Ӧ���������̣������ƺ�����أ���Ӧ�����ӷ���ʽΪ6H++ 5SO32��+2MnO4��=2Mn2++5SO42��+3H2O���ʴ�Ϊ��6H++ 5SO32��+2MnO4��=2Mn2++5SO42��+3H2O��
�ܸ��������Һ����ɫ����Ӧ����Һ��ɫ����˵ζ�ʱ��ͨ������Ҫ����ָʾ������ΪKMnO4��������ָʾ�������ﵽ��Ӧ�յ�ʱ������һ��KMnO4��Һ������ʹ��Һ����������ɫ�仯������ָʾ�յ㣻�ﵽ�ζ��յ��ȡ����ʱ��������Һ�棬���¸��������Һ�����ƫС������c(����)=![]() ���ⶨ���ƫ�ͣ��ʴ�Ϊ��KMnO4��������ָʾ�������ﵽ��Ӧ�յ�ʱ������һ��KMnO4��Һ������ʹ��Һ����������ɫ�仯������ָʾ�յ㣻ƫ����
���ⶨ���ƫ�ͣ��ʴ�Ϊ��KMnO4��������ָʾ�������ﵽ��Ӧ�յ�ʱ������һ��KMnO4��Һ������ʹ��Һ����������ɫ�仯������ָʾ�յ㣻ƫ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A.��Ϊͬ������������ʵ�������ȫ��ͬ
B.��Ϊͬ�������������֮�䲻�����ת��
C.�����ͳ���֮���ת���������仯
D.����ʽΪC2H6O������������ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t��ʱ�������������ܱ������з�����Ӧ:X(g)+3Y(g)![]() 2Z(g)��������ڲ�ͬʱ�̵�Ũ�����������˵����ȷ����( )
2Z(g)��������ڲ�ͬʱ�̵�Ũ�����������˵����ȷ����( )
���� | X | Y | Z |
��ʼŨ��/mol/L | 0.1 | 0.2 | 0 |
2minĩŨ��/mol/L | 0.08 | a | b |
ƽ��Ũ��/mol/L | 0.05 | 0.05 | 0.1 |
A. ƽ��ʱ��X��ת����Ϊ20% B. t��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ40
C. ����ƽ������ϵѹǿ��v������v���С��ƽ��������Ӧ�����ƶ� D. ǰ2min�ڣ���Y�ı仯���ʾ��ƽ����Ӧ����v(Y)=0.03mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ����( )
A. ��Ũ����ֱ��MnO2��KClO3��Ӧ�Ʊ�1mol������ת�Ƶĵ�������Ϊ2NA
B. 1molH2O�����γ�4NA�����
C. �����£� pH=2��H2SO4��Һ1L�У������ˮ�����H+����Ϊ0.01NA
D. ���³�ѹ�£� O2��O3�Ļ������16g����������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ζ���ѧ���о���Ա����Ŀɺ���������̼�����ѡ����2016��ʮ�������� ��صĹ���ԭ����ͼ��ʾ������˵������ȷ����( )
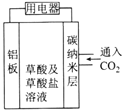
A. ��װ�ÿɽ���ѧ��ת��ɵ���
B. �����ĵ缫��ӦʽΪ2CO2+2e-=C2O42-
C. ���ø�װ�ò����ɼ���CO2���ŷţ��������ö�����̼��Դ
D. ��װ���е����缫���Ͼ������ģ��趨�ڲ��䡢����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��a��b��c��Ϊ�ǽ������ʣ�d��e��Ϊ����10�����ӵĹ��ۻ�����ҷ���������ԭ�Ӹ�����d��e��fΪ���ӻ����������˵���������
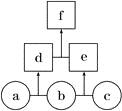
A. �����£�����a����̬ B. ����c����ǿ������
C. �ȶ��ԣ�d��e D. f�����ֽ�Ϊd��e
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20 mL 0.5 mol��L-1������Һ����μ����ռ���Һ���ⶨ�����Һ���¶ȱ仯��ͼ��ʾ�����й��ڻ����Һ��˵����������
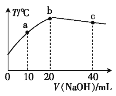
A. b��֮ǰ�¶���������Ϊ�����˷��ȷ�Ӧ
B. bc���¶Ƚ�������Ϊ����緢�����Ƚ���
C. c(NaOH)=0.5 mol��L-1
D. b��ʱ���ǡ�÷�Ӧ��ȫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������½�NaOH��Һ���ӵ������ᣨH2X����Һ�У������Һ��pH������Ũ�ȱ仯�Ĺ�ϵ��ͼ��ʾ�����������������

A. Ka2��H2X����������Ϊ10-6
B. ����N��ʾpH�� �ı仯��ϵ
�ı仯��ϵ
C. NaHX��Һ��c(H��)��c(OH��)
D. �������Һ������ʱ��c(Na��)��c(HX-)��c(X2-)��c(H+)=c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
(1)��֪����ͬ��������A��B��ȼ���ȵ��Ȼ�ѧ����ʽΪ��
A(s)+O2(g)�TCO2(g)��H����393.51 kJmol��1
B(s)+O2(g)�TCO2(g)��H����395.41 kJmol��1
������ͬ���������н��ȶ�����(����A������B��)_____��
(2)��ҵ����H2��Cl2��Ӧ��HCl������������Ϊ��H��H��436kJ/mol��Cl��Cl��243kJ/mol��H��Cl��431kJ/mol���÷�Ӧ���Ȼ�ѧ����ʽ��_____��
(3)�ϳ���(CO��H2Ϊ���Ļ������)��������Ҫ��ȼ��Ҳ����Ҫ�Ļ���ԭ�ϣ��Ʊ��ϳ����ķ����ж��֣��ü����Ʊ��ϳ����ķ�ӦΪ��
��2CH4(g)+O2(g)�T2CO(g)+4H2(g)����H1����72kJmol��1
��CH4(g)+H2O(g)�TCO(g)+3H2(g)����H2��+216kJmol��1
������������Ӧ����ˮ�������Ȼ�ѧ����ʽΪ_____������1mol��H2O(g)��O2��ɵĻ��������O2���������Ϊx�����˻����������CH4��ַ�Ӧ��
��x��0.2ʱ����Ӧ�ٷų�������Ϊ_____kJ��
��x��_____ʱ����Ӧ����ڷų�(������)��������Ϊ0��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com