
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 用浓盐酸分别和MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
B. 1molH2O最多可形成4NA个氢键
C. 常温下, pH=2的H2SO4溶液1L中,硫酸和水电离的H+总数为0.01NA
D. 常温常压下, O2与O3的混合气体16g,分子总数为NA
科目:高中化学 来源: 题型:
【题目】洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)实验室制氯气的化学方程式:________________________,此反应的氧化剂为:_____________ ;还原剂为:_____________;氧化剂与还原剂物质的量之比为:______________;
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式,并画出双线桥,标出电子转移的方向和数目:__________________________________。
(3)漂白粉的有效成分是________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
I.实验室中以粗铜(含杂质Fe)为原料制备铜的氯化物。现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹、酒精灯已省略)。按要求回答下列问题:
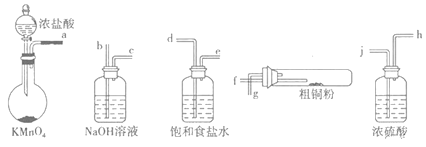
(1)按气流方向连接各仪器接口顺序是:a![]() ______________________________。
______________________________。
(2)写出加热时硬质试管中发生化学反应的方程式是______________________________。
(3)反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中正极反应式是_______________________________。
II.将上述实验制得的固体产物按如下流程操作,试回答下列问题:
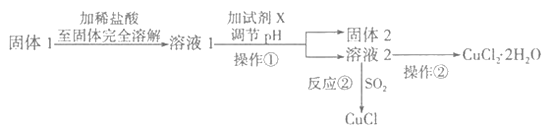
(1)检验溶液2中是否含有杂质离子的试剂是__________________。
(2)某同学用实验制得的CuCl2·2H2O晶体配制500mL0.1 mol·L-1的CuCl2溶液,在称量出CuCl2·2H2O晶体后,溶解该晶体的具体操作为_________________________________,分析以下操作对配制的溶液浓度造成的影响,影响偏高的是___________________________。
①蒸馏水洗完容量瓶后没有烘干 ②转移溶液过程中出现漏液
③砝码生锈 ④定容时俯视
(3)溶液l可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)_________。
a.NaOH b.NH3·H2O c.CuO d.CuSO4 e.Cu2(OH)2CO3
(4)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为V3++VO2++H2O![]() VO2++2H++V2+,下列说法正确的是( )
VO2++2H++V2+,下列说法正确的是( )
A. 放电时每转移2 mol电子,消耗1 mol氧化剂
B. 放电时正极反应为V O2++2H++e-=VO2++H2O
C. 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D. 充电过程中,H+由阴极区向阳极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分 CuFeS2)制取 FeSO4·7H2O 和Cu的主要流程如下:

(1)检验酸浸过程中 Fe2+是否被氧化,应选择________(填字母编号)。
A.KMnO4 溶液 B.K3[Fe(CN)6]溶液 C.KSCN 溶液
(2)酸浸过程中主要反应的化学方程式为__________。
(3)某同学向盛有 H2O2 溶液的试管中加入几滴酸化的 FeSO4 溶液,溶液变成棕黄色,发生反应的离子方程式为___________。一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成;产生气泡的原因是_________,生成沉淀的原因是___________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A.用pH试纸测定NaClO溶液的pH
B.电解饱和MgCl2溶液制取金属镁
C.用酸式滴定管量取20.00mL KMnO4溶液
D.滴定前用待测液润洗锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种重要的化工原料,但较易变质。
(1)实验室中欲检验Na2SO3固体样品是否已经变质,最简单的方法为_________________。
(2)某小组同学欲在实验室测定某Na2SO3样品的纯度。
方案一:通过测定生成SO2的质量,可计算mg Na2SO3固体样品的纯度。利用下列装置进行实验。
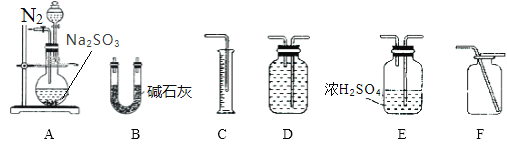
①选择装置A和B进行实验时,为使结果更精确还应选择装置_________________,装置A中反应前后通入N2的目的是_________________。
②实验结束后,若测得B装置增重了m1g,则该Na2SO3固体样品的纯度为__________。
方案二:利用高锰酸钾溶液滴定亚硫酸钠溶液,实现定量测定。称取a g样品,置于烧杯中;加入适量蒸馏水,使样品溶解,然后配制成250 mL溶液;准确量取25.00 mL溶液置于锥形瓶中;用0. 1 000mol/L的酸性KMnO4溶液进行滴定,经多次滴定,达到滴定终点时,平均消耗20.00 mL溶液。
③反应原理为(用离子方程式表示)_________________。
④滴定时,通常不需要加入指示剂,理由是_________________;达到滴定终点读取数据时,若俯视液面,则测定结果_________________(填“偏高”、“偏低”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. a>b>c>d B. d>a>b>c C. b>c>d>a D. a>b>d>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com