
| 13 |
| 2 |
| 13 |
| 2 |
| 9 |
| 2 |
| 9 |
| 2 |
| A、-2878kJ/mol |
| B、-2658kJ/mol |
| C、-1746kJ/mol |
| D、-1526kJ/mol |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| A、澄清的石灰水跟盐酸反应:H++OH-═H2O |
| B、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| D、金属钠跟水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使酸性高锰酸钾溶液褪色是因为H2SO3的漂白性 |
| B、H2SO3在空气中容易变质,成为SO2 |
| C、溶液中存在的微粒只有H+和SO32- |
| D、能与NaOH溶液发生复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
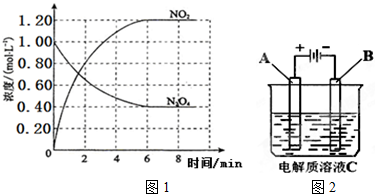
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
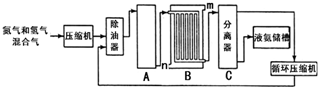
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com