



科目:高中化学 来源: 题型:
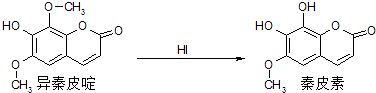
| A、异秦皮啶分子式为C11H14O5 |
| B、异秦皮啶与秦皮素均能与NaHCO3溶液反应,放出CO2 |
| C、异秦皮啶与秦皮素可用FeCl3溶液鉴别 |
| D、1mol的秦皮素最多可与4mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
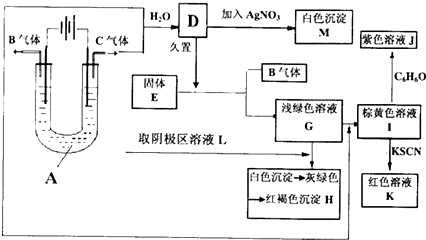
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面的银白色会逐渐褪去 | Na在空气中会生成Na202 |
| B | 铝箔插入浓硝酸中,无明显 | 铝与浓硝酸不反应 |
| C | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 溶液中有Fe3+生成 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2 L CCl4中含有的C-Cl键的个数为2NA |
| B、1 mol Na2O和Na2O2物中含有的阴、阳离子总数是3 NA |
| C、常温下,0.1 mol Cl2通入NaOH溶液中充分反应,转移电子数为0.2 NA |
| D、1 L 0.1 mol?L-1氨水溶液中所含的离子和分子总数大于0.1 NA但小于0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cu2+、Cl-、SO42- |
| B、H+、Cl-、CO32-、SO42- |
| C、Ba2+、Na+、SO42-、Cl- |
| D、H+、K+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、硫酸 |
| C、NaOH固体 |
| D、水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲 | B、乙 | C、丙 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| C、澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com