
| A、Na+、Cu2+、Cl-、SO42- |
| B、H+、Cl-、CO32-、SO42- |
| C、Ba2+、Na+、SO42-、Cl- |
| D、H+、K+、OH-、Cl- |


科目:高中化学 来源: 题型:
A、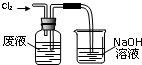 氧化废液中的溴化氢 |
B、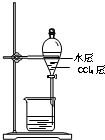 分离CCl4层和水层 |
C、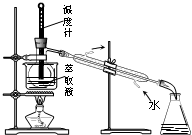 分离CCl4和液溴 |
D、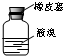 用仪器丁长期贮存液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2和A12O3都既能与酸反应,又能与碱反应 |
| B、硫化钠溶于水中发生反应的离子方程式为S2-+2H2O?H2S+2OH- |
| C、3.2 g Cu与5.5 mL l8.4 mol?L -1的浓H2SO4充分反应,转移的电子数为6.02×1022 |
| D、由水电离的c(H+)=1×10 -13mol?L -1的溶液中Cl-、HCO3-、NO3-、NH4+能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7K2=4.7×10-11 |
| HClO | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫原子的原子结构示意图: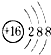 | ||
B、NH4Cl的电子式: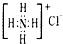 | ||
C、核内有8个中子的碳原子:
| ||
| D、HCO3-电离的离子方程式:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C、放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D、放电时的正极在充电时须接电源正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 冰醋酸 | 福尔马林 | 苛性钾 | HI | 乙醇 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 胆矾 | 石灰水 | 硫酸钡 | HNO2 | NH3 |
| A、A、 | B、B、 | C、C、 | D、D、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com