
【题目】(一)有以下几种物质:①碳酸氢钠晶体 ②液态氯化氢 ③铁 ④蔗糖 ⑤酒精 ⑥熔融的K2SO4 ⑦干冰 ⑧石墨。试回答(填序号):
(1)以上物质能导电的是_________________________。
(2)以上物质中属于非电解质的是_________________________。
(3)以上物质中溶于水后水溶液能导电的是_________________________。
(4)①、②在水溶液中反应的离子方程式为_________________________________。
(二)某溶液的溶质可能由下列离子组成:Cl-、![]() 、
、![]() 、H+、Ba2+、Na+,某同学进行了如下实验:
、H+、Ba2+、Na+,某同学进行了如下实验:
Ⅰ 向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
Ⅱ 向Ⅰ中滤液中加入AgNO3溶液,有白色沉淀产生;
Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
(5)依据以上实验可以推断,原溶液中一定含有____________ (用离子符号表示,下同);一定没有______________;可能含有________________,检验是否存在该离子的方法为_____________________________________________。
【答案】③⑥⑧ ④⑤⑦ ①②⑥⑦ H++HCO3-== H2O+ CO2↑ SO42-、CO32-、Na+ H+、Ba2+ Cl- 取少量溶液于试管中,向溶液中滴加硝酸酸化的AgNO3溶液,若产生白色沉淀,则证明原溶液中含有Cl-
【解析】
(1)据物质导电的原因分析,只要含有自由移动的离子或自由电子即可;
(2)在水溶液里或熔融状态下都不能导电的化合物是非电解质,包括非金属氧化物、一些氢化物和大部分有机物;
(3)根据物质导电的原因分析,只要水溶液含有自由移动的离子即可;
(4) 碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水;
(5)Ⅰ向溶液中加入过量的BaCl2溶液,有白色沉淀产生,说明原溶液中没有Ba2+;Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生可知一定含有SO42-和CO32-;由于加入BaCl2溶液引入了Cl-,所以不能由实验Ⅱ确定原溶液中是否含Cl-;而CO32-与H+不能大量共存,所以肯定不含有(大量)H+;这样,在3种阳离子中只剩下Na+了,则必然含有Na+;据以上分析解答。
(1)③铁、⑧石墨中均有自由电子,所以能导电,⑥熔融的K2SO4有自由移动的离子,所以能导电;①碳酸氢钠晶体、②液态氯化氢、④蔗糖、⑤酒精、⑦干冰中没有自由移动的离子或自由电子,所以不能导电;因此,本题正确答案是:③⑥⑧。
(2)在水溶液里和熔融状态下都不能导电的化合物是非电解质,④蔗糖、⑤酒精、⑦干冰属于非电解质;因此,本题正确答案是: ④⑤⑦。
(3)①碳酸氢钠晶体、②液态氯化氢、⑥熔融的K2SO4、⑦干冰等上述物质溶于水后,溶液中存在自由移动的离子而导电;因此,本题正确答案是: ①②⑥⑦。
(4)①碳酸氢钠溶液与盐酸反应生成二氧化碳和水,离子方程式为:H++HCO3-== H2O+ CO2↑;综上所述所,本题答案是:H++HCO3-== H2O+ CO2↑。
(5)Ⅰ向溶液中加入过量的BaCl2溶液,有白色沉淀产生,说明原溶液中没有Ba2+;Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生可知一定含有SO42-和CO32-;由于加入BaCl2溶液引入了Cl-,所以不能由实验Ⅱ确定原溶液中是否含Cl-;而CO32-与H+不能大量共存,所以肯定不含有(大量)H+;这样,在3种阳离子中只剩下Na+了,则必然含有Na+;
结合以上分析可知:原溶液中一定含有SO42-、CO32-、Na+;一定没有H+、Ba2+;可能含有Cl-;检验氯离子常用硝酸和硝酸银溶液,具体操作如下:取少量溶液于试管中,向溶液中滴加硝酸酸化的AgNO3溶液,若产生白色沉淀,则证明原溶液中含有Cl-;综上所述,本题答案是:取少量溶液于试管中,向溶液中滴加硝酸酸化的AgNO3溶液,若产生白色沉淀,则证明原溶液中含有Cl-。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
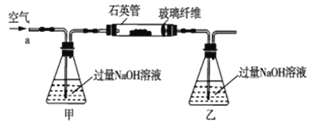
(实验一)测定硫元素的含量
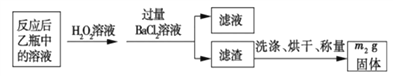
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00mL稀释液,用0.100mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列元素的原子半径,根据表中数据推测磷原子的半径可能是
原子 | N | S | O | Si |
半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10mB.1.10×10-10mC.1.20×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三水乳酸亚铁晶体[(CH3CHOHCOO)2Fe3H2O,Mr=288]是一种很好的补铁剂,易溶于水,吸收效果比无机铁好。可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3== FeCO3↓+Na2SO4
FeCO3+ 2CH3CHOHCOOH ==(CH3CHOHCOO)2Fe+CO2↑+H2O
(1)制备FeCO3时,选用的加料方式是______(填字母),原因是_______________________。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是__________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。
①铁粉的作用是_____________________。
②反应结束后,无需过滤,除去过量铁粉的方法及反应方程式是______________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得三水乳酸亚铁晶体。分离过程中加入无水乙醇的目的是_______________。
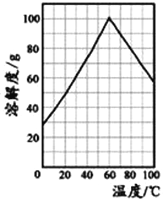
(5)某研究性学习小组从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3) 出发,经过一系列的实验步骤,最后制得到了硫酸亚铁溶液。请结合如图的绿矾溶解度曲线,将FeSO4溶液____________,得到FeSO4·7H2O晶体。
(6)该兴趣小组用标准KMnO4溶液测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于100%,其原因可能是____________________。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000molL-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.7mL。滴定反应为Ce4++Fe2+═Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时将a mol/L 氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A. a<1.0 B. 水的电离程度:b<d<c
C. C点:c(NH4+)=1.0mol/L D. d点:c(Cl-)<c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一。请回答下列问题:
二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃。
(1)基态Fe2+离子的价电子排布式为_______________________________
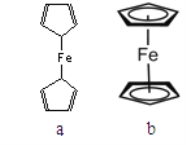
(2)二茂铁属于___________________晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为下图中的________________(选填“a”或“b”)
(3)环戊二烯(![]() )中C的杂化方式 _______________。1mol环戊二烯中含有σ键的数目为___________。
)中C的杂化方式 _______________。1mol环戊二烯中含有σ键的数目为___________。
(4)分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),在C5H5—中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上。C5H5—的大π键可以表示为______________。
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是_______
A.γ﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ﹣Fe晶胞边长为acm,α﹣Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
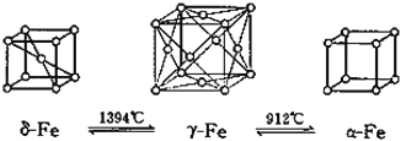
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体性质会产生重大影响。由于晶体缺陷,晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm-3,晶胞边长为4.28×10-10 m,则FexO中x=_____(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com