
奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.下列有关说法正确的是( )

A、合金的熔点通常比组分金属高,硬度比组分金属小
B、已知Ga处于ⅢA族,可推知氮化镓化学式为Ga3N2
C、用金属铝与V2O5冶炼钒,铝作还原剂
D、ETFE膜(CH2—CH2—CF2—CF2)是由两种单体缩聚而成的
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(2)用离子方程式表示E、F两种元素的非金属性强弱
还可以验证E、F两种元素非金属强弱的是(填写字母)
A.比较这两种元素的常见单质的沸点 B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的最高价氧化物水化物的酸性
(3) A、C、E两两之间可形成甲、乙两种微粒,它们均为带一个单位负电荷的双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液 显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入 ,将其中的Br-氧化,再用空气吹出 溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为 。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中, 显正电性。BrCl与水发生反应的化学方程式为 。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)=2 CuBr(s)+ Br2(g) △H=+105.4kJ/mol
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会 (填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国古代“药金”的冶炼方法是:将炉甘石(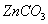 )和赤铜矿(
)和赤铜矿(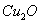 )与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”,下列叙述不正确的是( )
)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”,下列叙述不正确的是( )
A、“药金”实质上是铜锌合金
B、冶炼炉中炉甘石直接被碳还原为锌
C、用稀硫酸可区别黄金和“药金”
D、用火焰灼烧不可以区别黄金和“药金”
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外活动小组,从化学手册上查得硫酸铜在500 ℃以上可以分解成氧化铜、二氧化硫、三氧化硫和氧气,于是设计一验证性实验,探索测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系。实验用到的仪器如下图所示:

实验测得的数据及有关结果如下:
①准确称取2.4 g无水CuSO4;②干燥管的总质量在实验结束时增加了1.28 g;③测出量筒中水的体积后,折算成标准状况下气体的体积为112 mL。
试回答下列问题。
(1)装置C的作用是________,装置F的作用是________________________。
(2)将装置从左至右连接,各仪器接口的连接顺序为________________________。
(3)反应产生的O2的物质的量为________,SO3的物质的量为____________________。
(4)硫酸铜分解的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
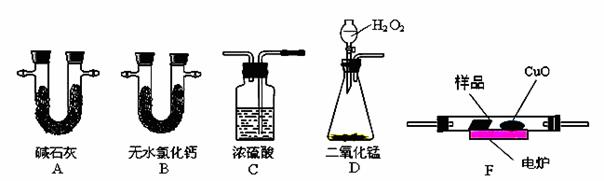
现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:
(1)按上述所给的测量信息,装置的连接顺序应是:___________________;
(2)C管中浓硫酸的作用是________________________________________;
(3)要确定该有机物的分子式,还必须知道的数据是_________________。
①C装置增加的质量②样品的摩尔质量③ CuO固体减少的质量
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com