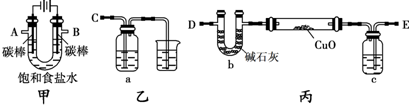
解:(1)D装置中电解饱和食盐水生成氢氧化钠、氯气、氢气,反应离子方程式为2Cl
-+2H
2O

2OH
-+H
2↑+Cl
2↑,
故答案为:2Cl
-+2H
2O

2OH
-+H
2↑+Cl
2↑;
(2)检验氯气的氧化性,应选择还原性物质,且反应现象明显.
A.氯气氧化碘化钾,生成碘单质,溶液变蓝色,故A正确;
B.酸性KMnO
4溶液,具有强氧化性,故B错误;
C.氯气氧化FeCl
2生成氯化铁,溶液变黄色,故C正确;
D.氯气氧化Na
2S生成硫,溶液变浑浊,故D正确;
故选:ACD;
(3)氯气有毒,污染环境,F装置的目的是吸收未反应的氯气,防止污染大气,故答案为:吸收未反应的氯气;
(4)①氢气是可燃性气体,与氧气混合,加热容易发生爆炸危险,加热氧化铜之前要通入氢气排尽装置内空气,
故答案为:通入氢气排尽装置内空气;
②由装置图与实验原理可知,装置A用于吸收反应产生的水,根据水的质量确定氧化铜中氧元素的质量,且A中盛放的为液体,应为浓硫酸,
故答案为:浓硫酸;
③氧化铜的质量为(b-a)g,反应后铜的质量为(c-a)g,故氧化铜中氧元素的质量为(b-a)g-(c-a)g=(b-c)g,令铜的相对原子质量为x,则x:16=(c-a)g:(b-c)g,解得x=

,故答案为:

.
分析:(1)D装置中电解饱和食盐水生成氢氧化钠、氯气、氢气,注意反应条件“通电”;
(2)检验氯气的氧化性,应选择还原性物质,且反应现象明显;
(3)氯气有毒,污染环境,F装置的目的是吸收未反应的氯气,防止污染大气;
(4)①氢气是可燃性气体,与氧气混合,加热容易发生爆炸危险,加热氧化铜之前要通入氢气排尽装置内空气;
②由装置图与实验原理可知,装置A用于吸收反应产生的水,根据水的质量确定氧化铜中氧元素的质量,且A中盛放的为液体,应为浓硫酸;
③氧化铜的质量为(b-a)g,反应后铜的质量为(c-a)g,故氧化铜中氧元素的质量为(b-a)g-(c-a)g=(b-c)g,利用化学式中元素的质量之比等于总的相对原子质量之比计算铜的相对原子质量.
点评:本题考查学生对实验原理的理解、物质组成的测定等,难度中等,理解原理是关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力.

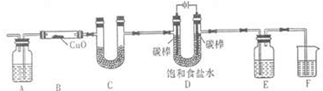 某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性.
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性. 2OH-+H2↑+Cl2↑,
2OH-+H2↑+Cl2↑, 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑; ,故答案为:
,故答案为: .
.

 名校课堂系列答案
名校课堂系列答案 某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性.
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性.