
| A. | 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 | |
| B. | 锡在常温下以灰锡状态存在 | |
| C. | 灰锡转化为白锡的反应是放热反应 | |
| D. | 灰锡和白锡的相互转化互为可逆反应 |
分析 A.由Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)可知,温度低于13.2°C时,白锡转化为灰锡;
B.由Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)可知,温度高于13.2°C时,以白锡状态存在;
C.灰锡转化为白锡的反应△H>0,灰锡转化为白锡的反应是吸热反应;
D.可逆反应要求正、逆反应在相同条件下进行.
解答 解:A.由Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)可知,温度低于13.2°C时,白锡转化为灰锡,灰锡以粉末状存在,故A正确;
B.由Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)可知,温度高于13.2°C时,以白锡状态存在,常温下高于13.2°C,因此常温下以白锡存在,故B错误;
C.由Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H=+2.1kJ/mol可知,灰锡转化为白锡的反应是吸热反应,故C错误;
D.灰锡和白锡的相互转化不是在相同条件下进行的,因此不是可逆反应,故D错误;
故选A.
点评 本题考查学生盖斯定律的应用以及物质的能量和其稳定性之间的关系,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 分子中的C、H、O的个数比为1:2:3 | B. | 分子中C、H个数比为1:2 | ||
| C. | 该有机物的相对分子质量为14 | D. | 该分子中肯定不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
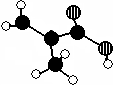 化工厂生产的某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
化工厂生产的某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 电离能/kJ•mol-1 | X | Y | Z |
| I1 | 496 | 738 | 577 |
| I2 | 4 562 | 1 451 | 1 817 |
| I3 | 6 912 | 7 733 | 2 754 |
| I4 | 9 540 | 10 540 | 11 578 |
| A. | 三种元素中,X元素的第一电离能最小,其电负性在同一周期元素中也最小 | |
| B. | 三种元素中,Y元素的第一电离能最大,其电负性也最大 | |
| C. | 等物质的量的X、Y、Z三种单质与少量盐酸反应时放出的氢气的物质的量之比为1:1:1 | |
| D. | 三种单质与盐酸反应放出等量氢气时,消耗X、Y、Z的物质的量之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{15}^{30}P$→${\;}_{14}^{30}Si$+x | B. | ${\;}_{7}^{14}N{+}_{0}^{1}n$→${\;}_{6}^{14}C$+x | ||
| C. | ${\;}_{27}^{60}Co$→${\;}_{28}^{60}Ni$+x | D. | ${\;}_{13}^{27}Al{+}_{2}^{4}He$→${\;}_{15}^{30}P$+x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
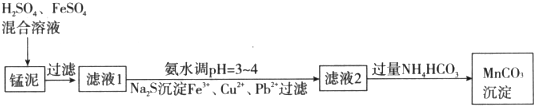
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族,单质的熔点逐渐降低 | |
| B. | ⅥA族,对气态氢化物还原性逐渐增强 | |
| C. | VA族氢化物的沸点逐渐升高 | |
| D. | ⅣA族最高氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com