
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
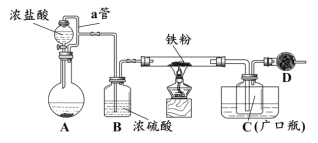
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________。仪器D的名称是__________________。
(2)D中装的药品是碱石灰,其作用是__________________________。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____(只能选取一种试剂,填序号)进行检测,实验现象是__________________________________。
①H2O2 溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________。
【答案】2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 球形干燥管 吸收未反应的Cl2,防止空气中的水进入装置C,使FeCl3潮解 ④ 溶液褪色 36.52 偏高 在AB装置间增加一个装有饱和食盐水的洗气装置,除去Cl2中混有的HCl
【解析】
(1)高锰酸钾与浓盐酸反应生成氯化钾、氯化镁、氯气和水,根据仪器构造判断其名称;
(2)根据氯化铁易吸收空气中的水分而潮解以及氯气有毒分析解答;
(3)根据氯化亚铁具有还原性分析解答;
(4)根据铁元素守恒解答;
(5)根据氯化铁和氯化亚铁中铁元素的质量分数分析判断;根据生成的氯气中含有氯化氢分析解答。
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O。仪器D的名称是球形干燥管。
(2)氯气有毒需要尾气处理,又因为氯化铁易吸收空气中的水分而潮解,所以D中装的药品是碱石灰,其作用是吸收未反应的Cl2,防止空气中的水进入装置C,使FeCl3潮解。
(3)氯化亚铁具有还原性,能使高锰酸钾溶液褪色,因此如果产物中混有FeCl2,可用酸性KMnO4溶液检验,答案选④,实验现象是溶液褪色;
(4)双氧水能把亚铁离子氧化为铁离子,加入氢氧化钠转化为氢氧化铁沉淀,灼烧转化为氧化铁,物质的量是2.4g÷160g/mol=0.015mol,根据铁元素守恒可知铁元素的质量是0.015mol×2×56g/mol=1.68g,则该样品中铁元素的质量分数为1.68g/4.6g×100%≈36.52%;
(5)①由于氯化铁中铁元素的质量分数小于氯化亚铁中铁元素的质量分数,则用题目所给的装置制得的产物中,如果铁元素含量偏高,则说明含有FeCl2杂质。
②由于生成的氯气中含有氯化氢,氯化氢能与铁反应生成氯化亚铁,则若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是在AB装置间增加一个装有饱和食盐水的洗气装置,除去Cl2中混有的HCl。


科目:高中化学 来源: 题型:
【题目】

请回答下列问题:
(1)实验室只有100 mL、250 mL、500 mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需取该浓硫酸 mL。
(2)接下来完成此实验你将用到的仪器有20 mL量筒、烧杯、玻璃棒、____________。
(3)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是________________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(4)下列操作会使所配溶液浓度偏低的是 。
A.用量筒量取浓硫酸,读数时仰视刻度线 |
B.转移溶液时未洗涤烧杯 |
C.容量瓶用蒸馏水洗净后仍残留有蒸馏水 |
D.定容时俯视容量瓶的刻度线 |
E.定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物,造成酸雨的主要原因,用如图所示装置可以既吸收工厂排放的废气中的SO2,又可以生成一定量的硫酸,下列说法正确的是

A. a为正极,b为负极
B. 生产过程中氢离子由右移向左
C. 从左下口流出的硫酸的质量分数一定大于50%
D. 负极反应式为SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屈昔多巴( ![]() )是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线(
)是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线( ![]() 简写为BnCl,
简写为BnCl, ![]() 简写为CbzCl ):
简写为CbzCl ):

回答下列问题:
(1)反应①的反应类型为_________,其作用为_____________。
(2)屈昔多巴中所含的非含氧官能团名称为_______________,屈昔多巴分子中有_____个手性碳原子。
(3)反应②为加成反应,则有机物X的名称为________________。
(4)![]() 显________性(填“酸”、“中”或“碱”)。
显________性(填“酸”、“中”或“碱”)。
(5)![]() 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。
(6)参照上述合成路线,以对羟基苯甲醛为原料(无机试剂任选),设计制备对羟基苯甲酸的合成路线: __________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
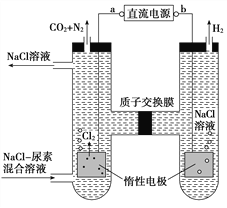
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,下图所示是从铝土矿中制备铝的工艺流程:

已知:溶液中硅酸钠与偏铝酸钠反应能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH。下列说法不正确的是
A. 滤渣A的成分为Na2Al2Si2O8和Fe2O3
B. 用过量CO2酸化,生成Al(OH)3的反应:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C. 过滤操作时,用玻璃棒搅拌,可以加快过滤速度
D. 灼烧操作前,坩埚需先洗净,再擦干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
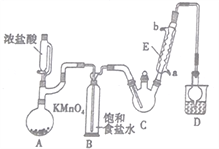
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器E的名称是____________,冷凝水的流向是________进_______出(填“a”或“b”)。
(2)该设计流程中存在一处缺陷,该缺陷是__________,引起的后果是_________________。
(3)仪器A中发生反应的离子方程式为____________________。
(4)该装置C可采用_______________,加热的方法以控制反应温度在70℃左右。
(5)装置D干燥管的作用为_______________,装置D烧杯中的试剂是_______________。
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是____________(填名称)。
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl
B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br-
D. .上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____________。
(2)该反应中发生氧化反应的物质是__________,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(3)48.0 g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 L气体(标准状况下),反应中消耗HNO3的物质的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质: FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______ ![]() ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并写出配平后的离子方程式:_________________________。
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念——“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是( )
A.Cu ![]() Cu(NO3)2
Cu(NO3)2
B.Cu ![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu ![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2 ![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com