
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示。则甲和X不可能是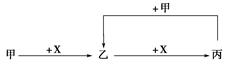
| A.甲为C,X为O2 |
| B.甲为SO2,X为NaOH溶液 |
| C.甲为Fe,X为Cl2 |
| D.甲为AlCl3溶液,X为NaOH溶液 |
C
解析试题分析:A、甲为C,X是O2,则乙为CO,丙为CO2。丙(CO2)和甲(C)反应又可以生成乙(CO),所以符合转化关系,故A不选;B、甲为SO2,X是NaOH溶液时,乙为NaHSO3,丙为Na2SO3,丙(Na2SO3)和甲(SO2)反应加上H2O又可以生成乙(NaHSO3),符合转化关系,故B不选;C、甲为Fe,X为Cl2时,乙为FeCl3,氯化铁与氯气不反应,不符合转化关系,故C符合题意;D、甲为AlCl3溶液,X为NaOH溶液时,乙为Al(OH)3,氢氧化铝和NaOH反应生成偏铝酸钠,偏铝酸钠好氯化铝反应又生成氢氧化铝白色沉淀,符合转化关系,故D不选,答案选C。
考点:考查无机物的推断以及元素及其化合物转化的有关判断


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。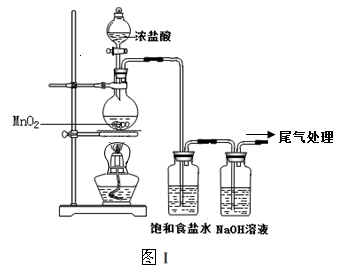

实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是 。
(2)饱和食盐水的作用是 。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H2O(l)??H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)??H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议: 。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是 。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是( )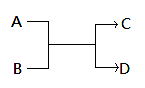
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X互换后也能符合要求)是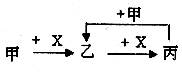
①Na2CO3溶液和稀盐酸;②Cl2和Fe;③C和O2;④SO2和NaOH溶液;⑤AlCl3溶液和NaOH溶液
| A.①②③④均可以 | B.②③④⑤均可以 |
| C.①②③⑤均可以 | D.①③④⑤均可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
①C、CO ②AlCl3、Al(OH)3
③Na、Na2O ④NaOH 、Na2CO3
A.①②③ B.①②
C.③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。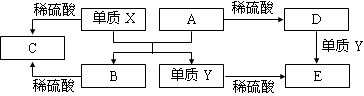
则下列说法正确的是
A.X与A反应的化学方程式是:Al2O3 + 2Fe Fe2O3 + 2Al
Fe2O3 + 2Al
B.检验D溶液中的金属阳离子的反应:Fe3++3SCN—=Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体,过量G与J溶液反应生成M。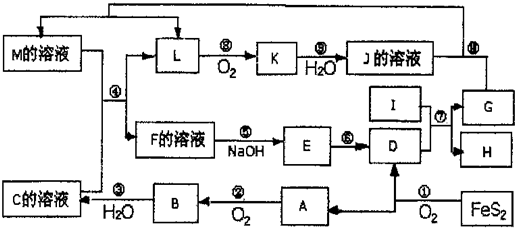
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(3)简述M溶液中阳离子的检验方法 。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。
(5)将化合物D与KNO3、KOH高温共熔,可制得一种“绿色”环保高效净水剂K2FeO4,同时还生成KNO2和H2O,该反应的化学方程式是_________________________。
(6)镁与金属I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg与金属I的单质在一定温度下熔炼获得。
①熔炼制备该合金时通入氩气的目的是 。
② I电池性能优越,I-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。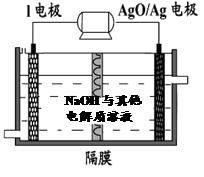
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列
问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图表示常见元素单质及化合物相应转化关系,部分反应的产物没有全部列出。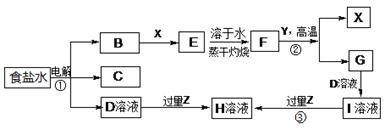
已知:B是一种黄绿色气体,C在所有气体中密度最小,D是一种碱;X、Y是生活中应用最为广泛的金属,F是一种红棕色氧化物,常用作红色油漆和涂料;Z为气态氧化物。
请回答下列问题:
(1)气体B具有 (填“还原性”、“氧化性”或“漂白性”),反应②属于四种基本反应类型反应中的 。
(2) 有学生认为B与X反应的产物E不一定是纯净物。他认为产物中可能还有 (填化学式),为验证其猜想该同学设计了相关实验,你认为他需要选择的试剂为 (填序号)。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.KSCN溶液 d.稀硫酸
(3)若Z能导致温室效应,则反应③的离子反应方程式为 。
(4)若Z是我国酸雨形成的罪魁祸首,目前应用最广泛的工业处理含Z废气的方法是在一定条件下与生石灰作用而使其固定,产物可作建筑材料,反应的化学方程式为 。
(5)若Z是形成酸雨的另一种主要物质,Z与足量的D溶液反应时能被完全吸收,且生成两种盐(物质的量之比为1:1),请写出该反应的化学反应方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com