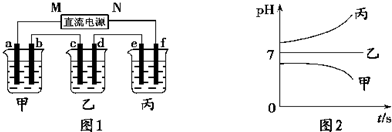
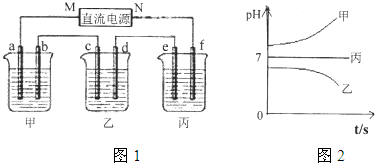
��12�֣�A��B��C����ǿ����ʣ�������ˮ�е�������������±���ʾ��
������
| Na+��K+��Cu2+
|
������
| SO42����OH��
|
��ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��������A��Һ��������B��Һ��������C��Һ���缫��Ϊʯī�缫��


��ͨ��Դ������һ��ʱ��������c�缫����������16g�������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵͼ���ϡ��ݴ˻ش��������⣺
��1��MΪ��Դ��
������д�������������缫b�Ϸ����ĵ缫��ӦΪ
��
��2������缫e�����ɵ������ڱ�״̬�µ������
��
��3��д�����ձ��ĵ��ط�Ӧ
��4�������������B��Һ�еĽ�������ȫ����������ʱ����ܷ�������У�Ϊʲô��
��5��������һ��ʱ��������c�缫����������16g��Ҫʹ���ָ���ԭ����״̬��������
��



 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д� �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�