
| A. | 0.1mol•L-1的Na2S溶液中,S2-的数目小于0.1NA | |
| B. | 0.1mol丙烷中含有的共价键数目为0.8NA | |
| C. | 标准状况下,11.2L甲醇中含有的分子数目为0.5NA | |
| D. | 0.1mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3NA |
分析 A、溶液体积不明确;
B、1mol丙烷中含10mol共价键;
C、标况下,甲醇为液体;
D、Na2O和Na2O2均由2个阳离子和1个阴离子构成.
解答 解:A、溶液体积不明确,无法计算出硫离子的个数,故A错误;
B、1mol丙烷中含10mol共价键,故0.1mol丙烷中含1mol共价键,即NA个,故B错误;
C、标况下,甲醇为液体,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、Na2O和Na2O2均由2个阳离子和1个阴离子构成,故0.1molNa2O和Na2O2的混合物中,无论两者的比例如何,其含有的离子均为0.3mol,个数为0.3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,注意把握公式的使用和物质的结构,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 | |
| B. | 由苯制取溴苯、硝基苯、环己烷的反应类型均属于取代反应 | |
| C. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| D. | 乙酸乙酯、乙酸、乙醇均能和水互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱、Na2O2、NH4NO3、Ca(OH)2均为离子化合物 | |
| B. | HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 | |
| C. | 经分析某物质只含有一种元素,则该物质一定是纯净物 | |
| D. | 金属氧化物一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 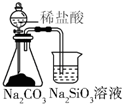 用此图可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 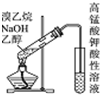 用此图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| C. |  根据此图装置中U型管液面现象,证明装置漏气 | |
| D. | 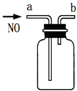 用此图装置收集一瓶纯净的NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
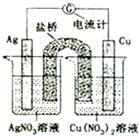 如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )| A. | 电子从铜电极经导线和盐桥流向银电极 | |
| B. | 电池工作时,K+向铜极的烧杯移动 | |
| C. | 工作一段时间后,右烧杯中溶液的pH变小 | |
| D. | 将AgNO3溶液更换为Fe(NO3)2溶液,电流计指针反向偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
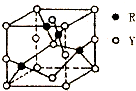 X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素; R+离子的3d轨道全充满.请回答下列问题:
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素; R+离子的3d轨道全充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 | B. | 0.05mol/L | C. | 0.5 mol/(L.s) | D. | 0.05 mol/(L.s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com