
分析 (1)四溴化锗的熔沸点低,所以GeBr4是分子晶体;锗与溴形成四个共价键,所以中心原子的杂化类型为sp3;
(2)同周期主族元素电负性从左到右渐增;
(3)CO的电子数为14,含有2个原子,根据等电子体的定义分析;根据NH3中N原子为杂化sp3,有一对弧对电子对,所以分子的空间构型为三角锥形;
(4)钒元素的基态原子的简化电子排布式式[Ar]3d34s2,其价电子是排布式为3d34s2,根据价电子排布判断电离能的大小.
解答 解:(1)四溴化锗的熔沸点低,所以GeBr4是分子晶体;锗与溴形成四个共价键,所以中心原子的杂化类型为sp3,故答案为:分子晶体;sp3;
(2)同周期主族元素电负性从左到右渐增,所以第四周期电负性由大到小的顺序:Br>Se>As,故答案为:Br>Se>As;
(3)CO的电子数为14,含有2个原子,它的等电子体有等CN-、C22-,NH3中N原子为杂化sp3,有一对弧对电子对,所以分子的空间构型为三角锥形,故答案为:CN-、C22-;三角锥形;
(4)钒元素的基态原子的简化电子排布式式[Ar]3d34s2,其价电子是排布式为3d34s2,Zn原子的价电子排布式为3d104s2,价电子中3d、4s轨道为全充满状态,原子较稳定,故Zn的第一电离能大于Ga,
故答案为:3d34s2;Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga.
点评 本题考查较为综合,晶体类型的判断、价电子是排布、电负性和电离能等知识,题目难度中等,注意原子核外电子排布与物质性质的关系,当价层电子轨道处于全空、全充满、半充满时,较稳定.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 气体乙中一定含有CO2可能含有SO2 | |
| B. | 白色沉淀丁一定是AgCl | |
| C. | 固体粉末M中一定含有Cu、FeO,可能含有Fe2O3 | |
| D. | 固体乙中一定含有Fe2O3和CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B2A2和B2A中阴阳离子的个数比相同 | |
| B. | 原子半径的大小顺序:r(D)>r(C)>r(B)>r(A) | |
| C. | D的简单气态氢化物的热稳定性比A的强 | |
| D. | 元素C的单质是一种高硬度、高熔点的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
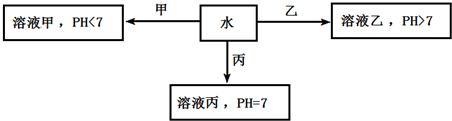
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.| CO2%-CO%-H2% (体积分数) | 0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | ||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
| 生成CH3OH的碳转化率(%) | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的Na2S溶液中,S2-的数目小于0.1NA | |
| B. | 0.1mol丙烷中含有的共价键数目为0.8NA | |
| C. | 标准状况下,11.2L甲醇中含有的分子数目为0.5NA | |
| D. | 0.1mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;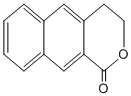 是一种重要的药物合成中间体,请结合题目所给信息,
是一种重要的药物合成中间体,请结合题目所给信息,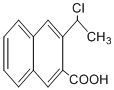 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: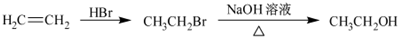
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
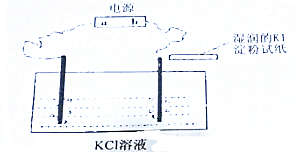
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质、油脂都是天然高分子化合物 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白质发生盐析 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com