

| A. | 气体乙中一定含有CO2可能含有SO2 | |
| B. | 白色沉淀丁一定是AgCl | |
| C. | 固体粉末M中一定含有Cu、FeO,可能含有Fe2O3 | |
| D. | 固体乙中一定含有Fe2O3和CuO |
分析 溶液甲加入过量稀硝酸,生成气体乙可使澄清石灰石变浑浊,则气体乙含有CO2,说明M中含有Na2CO3,溶液乙加入硝酸银生成白色沉淀,可能为AgCl,也可能为硫酸银,固体甲加入过量稀盐酸得到溶液丙,丙加入K2Fe(CN)6生成蓝色沉淀,说明丙中含有Fe2+,可有FeO与盐酸生成,也可能由Fe2O3、Cu与盐酸生成,溶液丙加入过量氢氧化钠,经过滤、洗涤、灼烧得到固体乙2.40g,用CO还原得到固体丙1.76g,一定含有Fe2O3,可能含有CuO,可根据质量关系利用端值法判断.
解答 解:A.溶液甲加入过量稀硝酸,生成气体乙可使澄清石灰石变浑浊,则气体乙含有CO2,不可能含有SO2,因SO2可被硝酸氧化生成硫酸,故A错误;
B.溶液乙加入硝酸银生成白色沉淀,可能为AgCl,也可能为硫酸银,故B错误;
C.丙加入K2Fe(CN)6生成蓝色沉淀,说明丙中含有Fe2+,可有FeO与盐酸生成,也可能由Fe2O3、Cu与盐酸生成,故C错误;
D.固体乙2.40g,用CO还原得到固体丙1.76g,如乙全部为Fe2O3,则可生成m(Fe)=$\frac{56×2}{56×2+3×16}×2.40g$=1.68g<1.76g,则固体乙中应还含有CuO,故D正确.
故选D.
点评 本题考查物质的检验和鉴别的实验方案的设计,侧重于元素化合物知识的综合运用以及学生的分析、计算能力的考查,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断,易错点为C和D,注意体会.


科目:高中化学 来源: 题型:选择题
 脑白金又名褪黑激素,据报道它具有提高免疫力、促进睡眠等功能.其结构简式为下列有关脑白金的说法不正确的是( )
脑白金又名褪黑激素,据报道它具有提高免疫力、促进睡眠等功能.其结构简式为下列有关脑白金的说法不正确的是( )| A. | 能发生加成反应 | B. | 属于芳香族化合物 | ||
| C. | 分子式为C14C16N2O2 | D. | 不能使高锰酸钾酸性溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为向100mL 2mol/L AlCl3溶液中加入2mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:
如图为向100mL 2mol/L AlCl3溶液中加入2mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8:1 | B. | 2:1 | C. | 1:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物酶固氮相比人工固氮更高效、条件更温和 | |
| B. | 近日用地沟油炼制的生物航油载客首飞,标志着我国航空业在节能减排领域进入商业飞行阶段 | |
| C. | 分光光度计不能用于测定草酸与高锰酸钾的反应速率 | |
| D. | 尿液燃料电池的原理是在微生物作用下将尿液中的有机物转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 | |
| B. | 由苯制取溴苯、硝基苯、环己烷的反应类型均属于取代反应 | |
| C. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| D. | 乙酸乙酯、乙酸、乙醇均能和水互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | ||
| A | X | C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
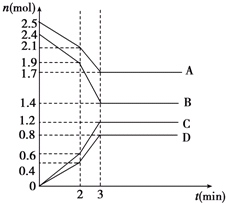 在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题:
在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com