
【题目】一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态。下列说法正确的是
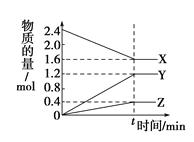
A. 该反应的化学方程式为: 2X![]() 3Y + Z
3Y + Z
B. 10s时Y的平均速率为0.12 mol·L-1·min-1
C. X的转化率为66.7%
D. 增大压强,该反应速率一定加快
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸( ![]() =1.84g/mL﹣1)配制成浓度为3.68mol/L﹣1的稀硫酸500mL.请按要求填空:
=1.84g/mL﹣1)配制成浓度为3.68mol/L﹣1的稀硫酸500mL.请按要求填空:
(1)所需浓硫酸的体积为mL
(2)请将下列操作按正确的序号填在横线上:
A用量筒量取浓硫酸 B反复颠倒摇匀 C用胶头滴管加水至刻度线 D洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶 E稀释浓硫酸 F将溶液转入容量瓶 G向容量瓶中加入适量蒸馏水至距离刻度线1~2cm处
其操作正确顺序为 .
(3)使用容量瓶前需要先进行操作的是 ,
(4)若实验中出现下列现象对所配溶液有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即进行定容 ,
②定容时俯视刻度线 ,
③配制前容量瓶内有水 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机反应类型的认识中,错误的是
A. ![]() ;取代反应
;取代反应
B. CH2=CH2 + Br2![]() CH2Br-CH2Br;加成反应
CH2Br-CH2Br;加成反应
C. 2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;取代反应
2CH3CHO+2H2O;取代反应
D. CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3+H2O;取代反应
CH3COOCH2CH3+H2O;取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( ) 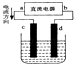
A.a为负极、b为正极
B.d为阳极,电极反应为:2Cl﹣﹣2e﹣=Cl2↑
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第4周期ⅥA族元素,下列叙述不正确的是( )
A. 硒是一种金属性很强的元素 B. 硒可以形成SeO2和SeO3
C. 硒的氢化物化学式为H2Se D. 硒的最高价氧化物对应水化物的化学式是H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g) ![]() pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
pC(g) △H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )

A. T1<T2,P1>P2,m+n>p,△H>0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1>T2,P1<P2,m+n<p,△H<0
D. T1>T2,P1>P2,m+n>p,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①﹣⑨在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)写出⑧的原子结构示意图 .
(2)④、⑤、⑥的原子半径由大到小的顺序为(用元素符号回答).
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(用化学式回答).
(4)②与④形成的原子个数比为1:2化合物的电子式为 .
(5)⑥的单质与①、④、⑤三种元素形成化合物的水溶液反应的离子方程式为: .
(6)②的最高价氧化物的熔沸点低于⑦的最高价氧化物的熔沸点,原因是 .
(7)⑤元素与⑨元素形成的化合物中,化学键类型为 , 高温灼烧该化合物时,火焰呈色.
(8)在②、③、⑦、⑧单质中,符合下列转化关系的是:(填元素符号).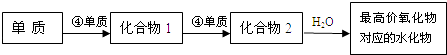
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) ![]() 4NO2(g) + O2(g) △H =+Q kJ/mol (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g) + O2(g) △H =+Q kJ/mol (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 5.0 | 3.5 | 2.5 | 2.5 |
下列说法正确的是
A. 500s内N2O5分解速率为6×10-3mol/(L·s)
B. 该温度下的平衡常数K =125
C. 反应达平衡时,吸收的热量为5Q kJ
D. 其他条件不变,若开始时c(N2O5)=10mol/L,则达平衡后c(N2O5)=5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com