
【题目】实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:

(1) “酸浸”需要加热的目的是__________,此过程中发生反应的离子方程式是______________。(任写一条)
(2) “熔融”过程中,MnO2被KC1O3氧化成K2MnO4。
①该反应的化学方程式为_____________________。
②加入KC1O3应过量的原因除了提高MnO2利用率,还有_________________.
③将适量KClO3和KOH混合均匀后在坩埚内高温反应,应选用坩埚为__________。(选填序号)
a.石英坩埚 b.铁坩埚 c.氧化铝坩埚
(3)己知:①MnO42-只存在于强碱环境(pH>13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③相关物质的溶解度曲线如下图。

请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2,_____________,低温供干得KMnO4晶体。
【答案】 加快反应速率 FeO+2H+=Fe2++H2O; Fe2O3+6H+=2Fe3++3H2O; MgO+2H+ =Mg2++H2O;
Al2O3+6H+=2Al3++3H2O;若写 2Fe2++4H++MnO2=Mn2++2Fe3++2H2O 等合理答案也给分。 3MnO2+KC1O3+6KOH![]() 3K2MnO4+KCl+3H2O KC1O3自身会分解 b 至pH≈12.3,过滤,将滤液蒸发浓缩,冷却结晶,过滤,洗涤
3K2MnO4+KCl+3H2O KC1O3自身会分解 b 至pH≈12.3,过滤,将滤液蒸发浓缩,冷却结晶,过滤,洗涤
【解析】本题以软锰矿为原料,考查常见无机物质高锰酸钾的制备,仔细分析每一个流程中加入的物质、发生的反应,主要产物及杂质,根据所学的知识即可较好的解决。加入稀硫酸,可除去杂质FeO、Fe2O3、MgO和Al2O3,滤渣为MnO2,加入氯酸钾和氢氧化钾熔融可得到高锰酸钾固体,溶解得到溶液,然后高锰酸钾和杂质的溶解度的差异,可分离出高锰酸钾。
(1)向软锰矿中加入稀硫酸,能将杂质转化为溶于水的物质,从而将杂质除去,为了加快反应速率,可以采取升温、将软锰矿粉碎、加大硫酸浓度等措施。金属氧化物与酸反应的离子方程式为:FeO+2H+=Fe2++H2O; Fe2O3+6H+=2Fe3++3H2O; MgO+2H+ =Mg2++H2O;Al2O3+6H+=2Al3++3H2O;MnO2有氧化性,能与Fe2+ 发生:2Fe2++4H++MnO2=Mn2++2Fe3++2H2O 。故答案为:加快反应速率;离子方程式按上述任写一个。
(2) ①在KOH存在下,MnO2被KC1O3氧化成K2MnO4 ,KC1O3 被还原为KCl,发生的反应为: 3MnO2+KC1O3+6KOH![]() 3K2MnO4+KCl+3H2O 。 ② 加大一种反应物的用量,往往可以使另一种反应物的转化率提高,本题加入过量的KC1O3,可以太高MnO2的转化率,提高其利用率;高温下KC1O3自身会分解,降低MnO2利用率,故KC1O3要过量。答案为: KC1O3自身会分解 ③KOH为强碱,具有强腐蚀性,高温下腐蚀性更强,能与SiO2、Al2O3发生反应,故不能选用,只能用铁坩埚,答案选b。
3K2MnO4+KCl+3H2O 。 ② 加大一种反应物的用量,往往可以使另一种反应物的转化率提高,本题加入过量的KC1O3,可以太高MnO2的转化率,提高其利用率;高温下KC1O3自身会分解,降低MnO2利用率,故KC1O3要过量。答案为: KC1O3自身会分解 ③KOH为强碱,具有强腐蚀性,高温下腐蚀性更强,能与SiO2、Al2O3发生反应,故不能选用,只能用铁坩埚,答案选b。
(3)浸取液中含有K2MnO4及杂质KCl,相同温度下,KMnO4和K2CO3溶解度差异很大,所以缓慢通入CO2气体至溶液pH约为12.3,K2MnO4转化为KMnO4和固体MnO2,同时生成K2CO3,过滤得到滤液 KMnO4、 K2CO3 、KCl及其他少量杂质,相同温度下 K2CO3 、KCl及其他少量杂质溶解度大于KMnO4 ,故可将将滤液蒸发浓缩,冷却结晶到较低温度,过滤,洗涤就可得到较纯的KMnO4晶体,然后低温烘干即可。答案为:至pH≈12.3 ,过滤,将滤液蒸发浓缩,冷却结晶,过滤,洗涤


科目:高中化学 来源: 题型:
【题目】下列有关有机化合物结构和性质的说法正确的是
A. 乙烯、苯和乙酸均能与氢气发生加成反应
B. 某芳香烃的分子式为C10H14,常温下它可使酸性KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种
C. 1 mol的有机物(结构如右图)最多能与含5mol NaOH的水溶液完全反应

D. 蛋白质盐析会使蛋白质失去生理活性,加热、紫外线照射等措施可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用氯酸钾与密度为1.19gcm﹣3,溶质质量分数为36.5%的浓盐酸反应制取氯气。
I.反应方程式如下:___KClO3+ HCl= KCl+ Cl2↑+ H2O
(1)配平方程式,并用双线桥法表示上述反应中电子转移的方向和数目。
(2)若反应中被氧化的盐酸为5mol,则生成的氯气体积为__________(标准状况下)。
II.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题:

(1)证明氯气和水反应的实验现象为__________,反应的化学方程式是__________。
(2)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是__________,漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是__________。
III.乙同学用上述浓盐酸配置0.100 mol·L-1的稀盐酸480 mL,下列说法正确的是__________。
A.取用240 mL的容量瓶
B.应量取上述浓盐酸的体积为4.2mL
C.定容摇匀后发现液面低于刻度线,再加蒸馏水与刻度线相切,所配溶液浓度偏小
D.定容时,仰视刻度线所配溶液浓度偏大
E.量取上述浓盐酸的体积时俯视刻度线所配溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿的主要成分是Cu2S,可用于制取金属铜和铜盐。
(1)己知部分反应的热化学方程式如下:
C(s)+S2(g)=CS2(g) ΔH1=akJ·mol-1
Cu2S(s)+H2(g)=2Cu(s)+H2S(g) ΔH2=bkJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH3=ckJ·mol-1
则C(s)+2Cu2S(s)=4Cu(s)+CS2(g)的ΔH=_________kJ·mol-1(用含 a、b、c 的代数式表示)。
(2)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为_______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是______________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见如图。其原因是_____________。


③353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为:__________,CuCl+FeCl3=CuCl2+FeCl2。
(3)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见如图。转化时正极的电极反应式为_________________。
(4)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq) ![]() Cu2S(s)+2Cl-(aq),该反应的平衡常数K= ________[己知Ksp(CuCl)=1.2×l0-6,Ksp(Cu2S)=2.5×l0-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K= ________[己知Ksp(CuCl)=1.2×l0-6,Ksp(Cu2S)=2.5×l0-43]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH—O共价键放出463kJ的热量。反应2H2(g)+O2(g)=2H2O(g)的能量变化如右图所示。下列说法正确的是

A. 2H(g)→H2(g) ![]() H >0
H >0
B. 图中E1 = 932kJ
C. 图中E2 = 926 kJ
D. 2H2(g)+O2(g)=2H2O(g) ![]() H =-484 kJ·mol-1
H =-484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕捉、封存与再利用是实现温室气体减排的重要途径之一。
(1)二氧化碳的电子式为___________。
(2)下列利用二氧化碳的反应中原子利用率达100%的是_________(填序号)。
a.CO2+2NH3 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
b.CO2+CH4![]() CH3COOH
CH3COOH
c.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
d.![]()
(3)一种正在开发的利用二氧化碳制取甲醇的流程如下:
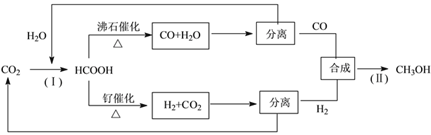
①反应(Ⅰ)将CO2和H2O转化为甲酸常用途径有两种,如下图(a)和(b)。
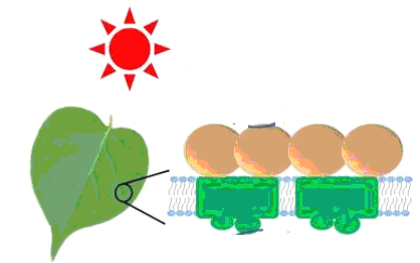
图(a)中能量主要转化方式为___________,图(b)中发生反应的化学方程式为___________。
②在5L的恒温恒容密闭容器中充入1moLCO和4molH2,加入催化剂发生反应,测得CO及CH3OH的物质的量随时间变化如下图所示。
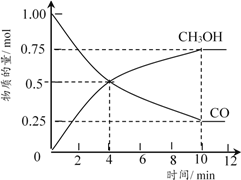
图中第___________min(填数字)反应达到平衡,CO在0~4min内的平均反应速率比在4~8min内的快,其原因是___________;达到平衡时氢气的浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.砷(As)是第四周期VA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图______________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________________________________。
(3)298K时,将20mL3×mol·L-1Na3AsO3、20mL3×mol·L-1I2和20ml NaOH溶液混合,发生反应:![]() 。溶液中
。溶液中![]() 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。
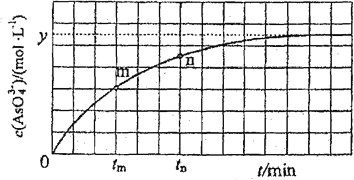
①下列可判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(![]() )
)
C.![]() /
/![]() 不再变化
不再变化
d.c(I-)=2ymol·L-1
②tm时,V正________V逆(填“大于”“小于”或“等于”)。
③tm时V逆________tm时V逆(填“大于”“小于”或“等于”),理由是____________________________。
Ⅱ.碳是重要的短周期元素,可以形成CO、CO2、CH3OH(甲醇)等化合物。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)________。
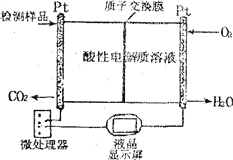
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。
写出该仪器工作时的总反应式及正极反应式:
总反应式__________________________
正极反应式__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com