
�����£��� 0.10 mol��L��1 NaOH��Һ�ֱ�ζ�20.00 mL 0.10 mol��L��1 HCl��Һ��20.00 mL 0.10 mol��L��1 CH3COOH��Һ���õ�2���ζ����ߣ�����ͼ��ʾ��������˵����ȷ����
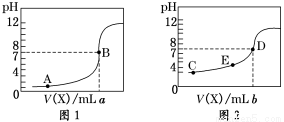
A��ͼ2�ǵζ����������
B��a��b�Ĺ�ϵ�ǣ�a<b
C��E���Ӧ����Ũ���ɴ�С��˳��Ϊ�� c(CH3COO��)>c(Na��)>c(H��)>c(OH��)
D�������εζ��������ü�����Ϊָʾ������ɫ�仯Ϊ����
C
��������
���������A��ͼ2�ڿ�ʼ�ζ�ʱ��Һ��pH=3����������ǿ�ᣬ��ȫ���룬0.10 mol��L��1 HCl��pH=1����ʵ����������ϣ��������ǵζ���������ߣ�����B����������������Ũ����ȣ������ͬ�����Ե��ζ��ﵽ��Һd��pH=7ʱ��a��b�Ĺ�ϵ�ǣ�a>b������C����E��ʱ��ҺΪ������Һ����Ӧ����Ũ���ɴ�С��˳��Ϊ�� c(CH3COO��)>c(Na��)>c(H��)>c(OH��)����ȷ��D���ü�ζ���ʱ��Ϊ�˼�С�ζ���Ӧ��ѡ����Һ����ɫ��dz����ĵı仯�ķ�̪��ָʾ������ɫ�仯Ϊ��ɫ���ɫ������
���㣺��������к͵ζ�ʱ�ĵζ����ߡ�������Һ�����������Ũ�ȵĴ�С�Ƚϡ���ָʾ����ѡ���֪ʶ��


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ϊ�ᴿ��������(������Ϊ����)�����õij����Լ��ͷ��뷽������ȷ����
��� | ������ | �����Լ� | ���뷽�� |
A | CH4(C2H4) | ����KMnO4��Һ | ϴ�� |
B | ������(Br2) | NaOH��Һ | ��Һ |
C | �Ҵ�(����) | ����Na2CO3��Һ | ��Һ |
D | C2H5OH(H2O) | ������ʯ�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������һ����Ч���������Ƽ�������Ч�ط�ֹ����ֲ�ų⣬��ṹ��ʽ����ͼ��ʾ�������й�����˵����ȷ���ǣ� ��
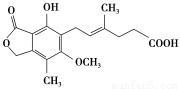
A����һ�������¿������������ӳɷ�Ӧ�������������5 mol
B��������FeCl3��Һ������ɫ��Ӧ
C����һ�������¿ɷ�����������ԭ��ȡ������ȥ��Ӧ
D��1 mol�����������3 mol NaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��ϩ����H2�ӳɺ�IJ�����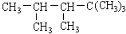 �����ϩ���Ľṹʽ�����У� ��
�����ϩ���Ľṹʽ�����У� ��
A��1�� B��2�� C��3�� D��4 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�����ݰ�У��������У������ѧ�Ծ��������棩 ���ͣ������
����Cu��Cu2O��CuO��ɵĻ�����У�����1 L 0.6 mol��L -1HNO3��Һǡ��ʹ������ܽ⣬ͬʱ�ռ���2240 mL NO���壨��״����������֪��Cu2O+2H+=Cu+Cu2++H2O��
��1��Cu2O��ϡ���ᷴӦ�����ӷ���ʽ ��
��2�����������������������H2���Ȼ�ԭ�����õ����������Ϊ g��
��3����������к�0.1 mol Cu�����û������ϡ�����ַ�Ӧ����������H2SO4�����ʵ���Ϊ ��
��һ���¶��£���һ�ݻ�Ϊ5 L�ĺ����ܱ������г���0.4 mol SO2��0.2 mol O2��������Ӧ��2SO2(g)��O2(g)  2SO3(g)������Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊ��ʼʱ��0.7����
2SO3(g)������Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊ��ʼʱ��0.7����
��ش��������⣺
��4���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�ı�־�� (����ĸ)��
A��SO2��O2��SO3���ߵ�Ũ��֮��Ϊ2��1��2 B�������������ѹǿ����
C�������ڻ��������ܶȱ��ֲ��� D��SO3�����ʵ������ٱ仯
E��SO2���������ʺ�SO3�������������
��5�� SO2��ת���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�����ݰ�У��������У������ѧ�Ծ��������棩 ���ͣ�ѡ����
��1100 �棬һ���ݻ����ܱ������з�����Ӧ��FeO(s)��CO(g)  Fe(s)��CO2(g)����H��a kJ/mol(a>0)�����¶���K��0.263�������йظ÷�Ӧ��˵����ȷ����
Fe(s)��CO2(g)����H��a kJ/mol(a>0)�����¶���K��0.263�������йظ÷�Ӧ��˵����ȷ����
A��������1 mol Fe�������յ�����С��a kJ
B���������¶ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ�������ѧƽ�������ƶ�
C����������ѹǿ����ʱ��仯��������жϸ÷�Ӧ�Ѵﵽ��ѧƽ��״̬
D���ﵽ��ѧƽ��״̬ʱ����c(CO)��0.100 mol/L����c(CO2)��0.0263 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���㽭ʡ�����ݰ�У��������У������ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������ij��̬������������Ļ�����ַ�Ӧ��ָ���ԭ�¶ȡ�ѹǿ����״������������������С�˶���֮һ������������̬���У�������������
A������B����ϩC����ȲD������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015����ϳ������ʵ����и߶���ѧ�ڵ�һ�ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��8�����ʣ��ټ��飻�ڱ����۾���ϩ����1,3--���ϩ����2-��Ȳ�������飻���ڶ��ױ������ϩ������ʹ���Ը��������Һ��ɫ��������ˮ��Ӧʹ֮��ɫ����( )
A���ۢܢݢ� B���ܢݢߢ� C���ܢݢ� D���ۢܢݢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������У������ѧ��λ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ�д��������һ��������
A��NH4+ ��Ag+��PO43-��Cl- B��Fe3+��H+��I-��HCO3-
C��K+��Na+��NO3- ��MnO4- D��Al3+��Mg2+ ��SO42- ��CO32-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com