
0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化硼和液态水放出649.5 kJ·mol-1热量,其热化学方程式为:_________________________;又已知H2O(l)=H2O(g) ΔH="44" kJ,则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是kJ。
B2H6(g)+3O2(g)====B2O3(s)+3H2O(l) ΔH="-2" 165 kJ·mol-1 1 016.5
【解析】
试题分析:要求解本题,首先弄清两点:一是反应物的物质的量与热量成正比;二是标明反应物和生成物的聚集状态。据方程式中乙硼烷的物质的量计算出反应热ΔH的值并正确地表示在方程式后面,计算B2H6的燃烧热:
649.5 kJ÷0.3 mol="2" 165 kJ·mol-1
所以热化学方程式表示为B2H6(g)+3O2(g)="===" B2O3(s)+3H2O(l) ΔH="-2" 165 kJ·mol-1
已知H2O(l)=H2O(g)吸收热量为44 kJ
据热化学方程式计算3 mol液态水吸热44 kJ×3="132" kJ
因而1 mol B2H6燃烧生成气态水时放出的热量为ΔH=-(2 165-132) kJ·mol-1="-2" 033 kJ·mol-1
则标况下11.2 L B2H6完全燃烧生成气态水时放出的热量为2 033 kJ·mol-1×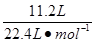 ="1" 016.5 kJ。
="1" 016.5 kJ。
考点:考查反应热的计算和热化学方程式的书写
点评:该题是高考中的常见考点之一,试题基础性强,难易适中,有助于培养学生的规范答题能力和逻辑思维能力。该题的关键是明确书写热化学方程式的注意事项,即①要标明反应物和生成物的状态;②放出热量的用“—”,吸收热量的用“+”;③方程式里的化学计量数表示物质的物质的量。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)0.3 mol气态高能燃料乙硼烷(分子式为B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,写出上述燃烧反应的热化学方程式:
;
(2)配平下列反应方程式:
□Na2SO3+□KIO3+□H2SO4=□Na2SO4+□K2SO4+□I2+□H2O
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省邢台一中高一下学期第三次月考化学试卷(带解析) 题型:填空题
(1)0.3 mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,则其热化学方程式为
(2)又已知:H2O(g) =H2O(l) ; ΔH="-44" kJ/mol,则5.6L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省浙东北三校高一下学期期中考试化学试卷 题型:填空题
(1)0.3 mol气态高能燃料乙硼烷(分子式为B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,写出上述燃烧反应的热化学方程式:
;
(2)配平下列反应方程式:
□Na2SO3+□KIO3+□H2SO4=□Na2SO4+□K2SO4+□I2+□H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com