
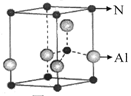




科目:高中化学 来源:不详 题型:填空题
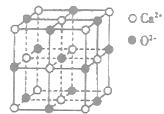
 ,下列有关说法正确的是________(填选项字母)。
,下列有关说法正确的是________(填选项字母)。| A.NaN3与KN3结构类似,前者晶格能较小 |
B.晶体钾的晶胞结构如右图所示,每个晶胞中分摊2个钾原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
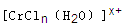 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: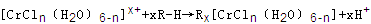
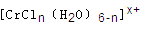 的溶液,与R-H完全交换后,中和生成的需浓度为
的溶液,与R-H完全交换后,中和生成的需浓度为查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键有________mol。
键有________mol。

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,其余各能层电子全充满。
,其余各能层电子全充满。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.SO2和O3、PO43-和ClO4-互为等电子体 |
| B.甲烷分子失去一个H+,形成CH3-,其碳原子的杂化类型发生了改变 |
| C.Ti原子的核外电子排布式为[Ar]3d34s2 |
| D.CS2、H2O、C2H2都是直线形分子 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C—O是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的空间构型为 (用文字描述)。
的空间构型为 (用文字描述)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com