
下列有关化学用语的说法中不正确的是
A.乙炔的最简式:CHB. 的系统命名:2-乙基丙烷
的系统命名:2-乙基丙烷
C.N2的结构式: N≡N D.苯的比例模型为:
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高二化学试卷(解析版) 题型:选择题
下列说法正确的是
A.第一电离能越小的元素其单质金属活泼性一定越大
B.电负性越小的元素金属性一定越强
C.元素电负性相差小于1.7的元素之间形成的化学键一定为共价键
D.制造光电材料的元素主要从IA族中寻找其主要原因是IA的第一电离能比较低
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省五校高三第二次联考理综化学试卷(解析版) 题型:填空题
(15分)已知2A(g)+B(g) 2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”、“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度 (填“>”“=”或“<”)ωmol/L,a、b、c之间满足何种关系 (用代数式表示)。
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A. 4 mol A和2 mol BB. 4 mol A、2 mol B和2 mol C
C. 4 mol A和4 mol BD. 6 mol A和4 mol B
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A. 及时分离出C气体B. 适当升高温度
C. 增大B的浓度D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”、“=”或“<”),理由是_ 。
⑹ 在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使之反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”、“变大”、“变小”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:选择题
取100mL Fe(NO3)3与Cu(NO3)2的混合液,若这两种溶液物质的量浓度相等。在混合液中加入2.5mol/L NaOH溶液150mL恰好反应,则原溶液中NO3-的浓度为
A.1.25mol/L B.3.75mol/L C.2.5mol/LD.5.0mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:选择题
下列关于常见有机化合物的说法中,不正确的是
A.甲烷和氯气反应生成一氯甲烷,苯和硝酸反应生成硝基苯,两者的反应类型相同
B.分子式为C5H12的有机物只有三种,它们互为同系物
C.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有碳碳双键
D.葡萄糖是人体内主要供能物质,血液中葡萄糖含量过低,会使人患“低血糖”症
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二下学期期中考试化学试卷(解析版) 题型:选择题
某有机物X(C4H6O5)广泛存在于许多水果内。该化合物具有如下性质:①1 molX与足量金属钠反应产生1.5 mol气体;②在有浓H2SO4和加热条件下,X与醇或羧酸均反应生成有香味的产物;③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应。根据上述信息,对X的结构判断正确的是 ( )
A.X中含有碳碳双键 B.X中可能有三个羟基和一个-COOR
C.X中可能有一个羧基和两个羟基 D.X中可能有两个羧基和一个羟基
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省豫东、豫北十所名校高三阶段性测试理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业。请回答下列问题。
(1)列举两种海水淡化的方法:_________、_________。
(2)氯碱工业通过电解饱和食盐水能获得烧碱和氯气等物质,该反应的化学方程式为_____________,如图是用离子交换膜法电解饱和食盐水的原理示意图。其中石墨接电源_________极,电解时铁电极的电极反应式为_________。电解过程中通过离子交换膜的主要离子是__________。

(3)侯氏制碱法中,首先向饱和食盐水中通入CO2和NH3制备NaHCO3,其化学方程式为____________;先通入的是__________(填化学式),其理由是__________________ ;再利用NaHCO3受热分解可制备纯碱。
(4)目前世界上60%以上的镁都是从海水中提取的,已知:MgO和MgCl2的熔点分别为2852℃和714℃。分析说明工业上采用电解熔融MgCl2而不是电解熔融MgO的理由__________ ______________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高三第二次模拟考试理综化学试卷(解析版) 题型:推断题
(14分)锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分。其中生产碳酸锰的工艺流程如下:
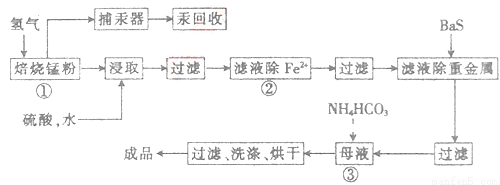
请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是________。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部
分被碳还原,MnO2被还原为一氧化锰。已知:

写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:________。
(3)50-55 时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+

(4)已知三种离子沉淀时的pH范围:Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6。步骤②中除去的方法是先在酸性条件下加入_________,将Fe2+氧化为Fe3+,然后再将pH调至_______,使Fe3+沉淀完全。
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com