
(15分)已知2A(g)+B(g) 2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”、“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度 (填“>”“=”或“<”)ωmol/L,a、b、c之间满足何种关系 (用代数式表示)。
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A. 4 mol A和2 mol BB. 4 mol A、2 mol B和2 mol C
C. 4 mol A和4 mol BD. 6 mol A和4 mol B
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A. 及时分离出C气体B. 适当升高温度
C. 增大B的浓度D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”、“=”或“<”),理由是_ 。
⑹ 在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使之反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”、“变大”、“变小”或“无法确定”)。
⑴ a>b ⑵< = a=b+c
⑶ D⑷ C
⑸>由于反应过程中恒压容器中压强大于恒容容器,所以转化率更大,放热更多
⑹ 不变 (1,1,1,2,2,2,2,2,2)
【解析】
试题分析:⑴该反应为可逆反应,则2 mol A和1 mol B不能完全反应,故a>b。
⑵该反应为放热反应,温度升高,平衡常数减小,故T1<T2;在同温下,在原容器中,只加入2 mol C(与原平衡的起始量“一边倒”后的数据完全相同),与原平衡的平衡状态完全相同,即C=ωmol/L;根据两平衡的转化率之和为100%,则有b+c=a。
⑶在相同条件下要想得到2a kJ热量,必须满足n(A)>4 mol,n(B)>2 mol,只有C项满足要求。
⑷A项不满足使该反应的反应速率增大;B项不满足平衡向正反应方向移动;D项平衡不移动。
⑸由于在反应过程中恒压容器中压强大于恒容容器,导致恒压容器中反应物的转化率更大,放热更多,即d>b。
⑹保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C即相当于“6 mol A、4 mol B”与原平衡的起始量(3 mol A和2 mol B)成等比关系,在恒压条件为等效平衡,故平衡时A的百分含量不变(与原平衡相同)。
考点:反应热、化学反应速率、平衡常数、等效平衡。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷二试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.用酸性高锰酸钾即可鉴别苯酚溶液,2,4-己二烯和甲苯
B. 按系统命名法化合物 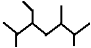 的名称为:2,5,6-三甲基-3-乙基庚烷
的名称为:2,5,6-三甲基-3-乙基庚烷
C. 新型解热镇痛抗炎药贝诺酯 在酸性条件下完全水解可以得到3种有机物
在酸性条件下完全水解可以得到3种有机物
D.β—月桂烯的结构如图 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种
,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高一化学试卷(解析版) 题型:实验题
某同学为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验
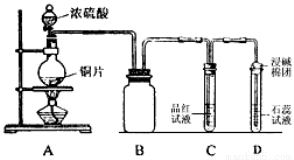
(1)B是用来收集实验中生成的气体的装置,但未将导管画全,请在答题卷上把导管补充
完整 。
(2)请写出铜跟浓硫酸反应的化学方程式 。
(3)实验中D中的现象 。
(4)实验中,该同学取6.4g铜片和12mL 18mol·L-1H2SO4溶液放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余;该同学根据所学的化学知识判断还会有一定量H2SO4的剩余,下列药品中能够用来验证反应停止后的烧瓶中确有剩余的H2SO4的是 填字母编号)。
a.BaCl2溶液 b.Ba(NO3)2溶液 c.银粉 d.Na2CO3粉末
(5)若将16g铜与50mLH2SO4物质的量浓度为一定值的浓硫酸反应,铜完全溶解。请回答:
①反应中产生的气体在标准状况下的体积为 L。
②该反应中被还原的H2SO4的物质的量为 mol。
③待产生的气体全部释放后,向溶液中滴加VmL a mol·L-1NaOH溶液,恰好使溶液中
的Cu2+全部转化为沉淀,则原浓硫酸中H2SO4的物质的量浓度= mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高一化学试卷(解析版) 题型:选择题
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。下列说法正确的是
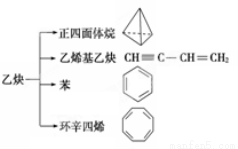
A.正四面体烷的分子式为C4H4,其二氯代物有两种
B.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
C.苯为平面六边形结构,分子中存在C—C和C==C,能使酸性KMnO4溶液褪色
D.环辛四烯跟苯的结构很像,不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高一化学试卷(解析版) 题型:选择题
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.原子核内有10个中子的氧原子:18O B.乙烯的结构简式: CH2CH2
C.CH4 分子的比例模型: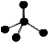 D.-CH3(甲基)的电子式为:
D.-CH3(甲基)的电子式为: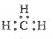
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省五校高三第二次联考理综化学试卷(解析版) 题型:选择题
泰雅紫是古代地中海沿岸出产的一种贵重染料,罗马帝王用法律规定,只有皇族与教主可穿用这种染料染的紫色衣袍。当时人们是从小的紫蜗牛中提取泰雅紫的,制备1.5 g泰雅紫需要多达12000只紫蜗牛,现知其结构为如下图所示的含溴有机化合物,下列说法不正确的是( )
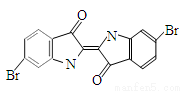
A.泰雅紫分子的分子式为C16H8N2Br2O2
B.1 mol泰雅紫与H2加成最多需9 mol H2
C.泰雅紫属于烃的衍生物
D.检验泰雅紫中溴元素可直接加入硝酸银溶液,观察是否有浅黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:实验题
下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙 酸乙酯,该反应的化学方程式为 。
【装置设计】甲、 乙、丙三位同学分别设计了下列三套实验装置:

若从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,选择的装置应是 (填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是 。
【实验步骤】
A 按所选择的装置组装仪器,在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸;
B 将试管固定在铁架台上;
C 在试管②中加入5 mL X试剂;
D 用酒精灯对试管①加热
E.当观察到试管②中有明显现象时停止实验。
【问题讨论】(1)实验中浓硫酸的作用是 。
(2)试管2中加入的X试剂为 。
(3)步骤E试管②中观察到的现象是 。
(4)常用 方法分离获得实验中的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:选择题
下列有关化学用语的说法中不正确的是
A.乙炔的最简式:CHB. 的系统命名:2-乙基丙烷
的系统命名:2-乙基丙烷
C.N2的结构式: N≡N D.苯的比例模型为:
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:填空题
【有机化学基础】(15分)
白酒产品中的塑化剂主要源于塑料接酒桶、塑料输酒管、成品酒塑料内盖等。DBP是塑化剂的一种,可由下列路线合成:

已知以下信息:

(1)A的结构简式是________,D的结构简式是________,D→E的反应类型是________。
(2)D和H2l:l反应生成E,则E官能团名称为________,DBP的分子式为________。
(3)由B和E以物质的量比1:2合成DBP的化学方程式为____________。
(4)写出同时符合下列条件的B的所有同分异构体的结构简式____________。
①能和NaHCO3溶液反应生成CO2 ③能使FeCl3溶液发生显色反应
②能发生银镜反应 ④苯环上含碳基团处于对位
(5)写出B与碳酸氢钠溶液反应的化学方程式________。
写出C生成D的反应的化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com