
【题目】乙酸乙酯的同分异构体(只考虑含有一种官能团)的种类数为( )
A. 5种 B. 6种 C. 7种 D. 8种
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛。
(1)根据下图写出合成氨的热化学方程式是__________________。

(2)将1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量____(填“大于”、“等于”或“小于”)92.9KJ,原因是_______;若加入催化剂,△H______(填“变大”、“不变”或“变小”)。
(3)已知分别破坏1molN≡N键、1molH-H键时需要吸收的能量为946KJ、436KJ。则破坏1molN-H键需要吸收的能量为___________KJ。
(4)发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g).
已知N2(g)+2O2(g)=2NO2(g)△H1=+67.7kJ/mol;
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol;
写出1mol N2H4与NO2反应的热化学方程式为_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含1mol HCl和1mol MgSO4的混合溶液中加入1 mo1·L-1Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系如图三其中正确的是
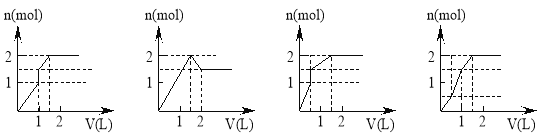
A. B. C. D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中,不正确的是
A. 用半透膜除去淀粉胶体中的NaCl溶液
B. 胶体中分散质粒子的直径小于1 nm
C. 利用丁达尔效应可以区分溶液和胶体
D. 用滤纸能分离胶体和悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:

(1)由强酸性条件即可判断溶液X中一定不存在的离子有 。
(2)溶液X中,关于NO3-的判断一定正确的是_ ___。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化④中产生H的离子方程式为 。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为____。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMnO4溶液,⑥氯水和KSCN的混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1) A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式: ______________________________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在元素周期表中的位置是______________________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为______________________,制得的气体可用如图所示装置收集,则气体应从______(填“A”或“B”)通入。

(4)由各分解产物的物质的量之比推测X的组成类似于明矾,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为_______________、___________________、_______________________________。
(5)取一定量的X晶体分解,若生成1 mol F,则必同时生成 ____________(填化学式)________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古文献中记载提取硝酸钾的方法是“此即地霜也。所在山泽、冬月地上有霜、扫取水淋汁、后煎炼而成”。该文献涉及的混合物分离方法是
A. 萃取 B. 蒸馏 C. 结晶 D. 升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
①增加水的量或温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③对反应3H2(g) + N2(g) ![]() 2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不改变。
④对于反应3KSCN(aq) + FeCl3(aq)![]() Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+ 3KC l(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①② B. ①④ C. ②④ D. 无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、二甲醚等广泛用于工农业生产中.已知: C(s)+H2O(g)═CO(g)+H2(g) △H=+131.3kJmol﹣1
CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.3kJmol﹣1
则炭与水蒸气反应生成二氧化碳和氢气的热化学方程式为___________________。该反应在____(填“高温”、“低温”或“任何温度”)下有利于正向自发进行.
Ⅱ.二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”。 利用煤制取的CO和H2为原料生产二甲醚主要发生以下三个反应:① CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=﹣24kJmol﹣1
CH3OCH3(g)+H2O(g)△H2=﹣24kJmol﹣1
③CO(g)+H2O(g)![]() CO2(g)+H2(g)△H3=﹣41kJmol﹣1
CO2(g)+H2(g)△H3=﹣41kJmol﹣1
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O |
| H﹣O | C﹣H |
E/(kJ·mol﹣1) | 436 | 343 | 1076 | 465 | 413 |
由上述数据计算△H1=______________;
(2)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)△H,该反应
CH3OCH3(g)+CO2(g)△H,该反应
△H=____________,
Ⅲ.在固定体积的密闭容器中,发生可逆反应:2NO2(g) ![]() N2O4(g)。已知Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的________(填“深”或“浅”),其原因是____________________________
N2O4(g)。已知Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的________(填“深”或“浅”),其原因是____________________________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com