
����Ŀ����ѧ�������������ͷ�չ�Ĺ���֮һ�Ƿ��ֺ������˸��ֲ��ϣ����磬�����������������в��ɻ�ȱ����Ҫ���ϣ�������ѧ�����йؽ�����֪ʶ���ش��������⣺
��1��ͭǮ���ҹ���ʷ��������һ�ֹ㷺��ͨ�Ļ��ң�ͭ������������ҵ�ԭ�������_______����ţ���
A��ͭ���۵㲻��̫�ߣ�����ұ�����������
B��ͭ�����ʲ����ã����ױ���ʴ
C���ҹ������������ʪ��ұ��ͭ�ļ���
D����Ȼ���д���������̬��ͭ
��2��������Ʒ��ʹ�ø�Ϊ�㷺����������Ʒ�����⣬�������Ҫ�ɷ���_______�������ƣ������������ﳣ���Ļ���_______��_______���ѧʽ����
��3������Ʒ��Ϊ�������γ����ܵ���������Ĥ���������ã����Ǹ�����Ĥ�ױ�����ƻ�����ʹ������������������Һ���ã���Ӧ�Ļ�ѧ����ʽΪ_____�����ӷ���ʽΪ______��

���𰸡�ABC����������FeOFe3O4Al2O3+2NaOH��2NaAlO2+H2OAl2O3+2OH����2AlO2��+H2O
��������
��1��A��ͭ���۵㲻��̫�ߣ�����ұ����������ͣ���Ӧ����������ң�A��ȷ��
B��ͭ�����ʲ����ã���������е�ˮ�����ȷ�Ӧ�����ױ���ʴ��B��ȷ��
C���ҹ������������ʪ��ұ��ͭ�ļ���������Fe������ͭ��Ӧ����Cu��C��ȷ��
D����Ȼ���д���ͭ���ɺ�����Cu��D����
��ѡABC��
��2������Ʒ�����⣬�������Ҫ�ɷ�������������������������������FeO��Fe3O4��
��3�������������������������������Һ��Ӧ����ƫ�����ƺ�ˮ����ѧ����ʽΪAl2O3+2NaOH��2NaAlO2+H2O�����ӷ���ʽΪAl2O3+2OH����2AlO2��+H2O��


 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL0.1mol/L��ijһԪ��HR��Һ����μ���0.1mol/L��ˮ��������ҺpH�����������仯��ͼ�����з�������ȷ���ǣ� ��

A. a��b�㵼��������ǿ˵��HRΪ����
B. a��b����ʾ��Һ��ˮ�ĵ���̶Ȳ���ͬ
C. bǡ����ȫ�кͣ�pH=7˵��NH4Rû��ˮ��
D. c ����Һ����c��NH4+����c��R-����c��OH-����c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ KMnO4 ��Һ�������(H2C2O4)��Һ��Ӧ��ij��ѧ̽��С�����÷�Ӧ��������Һ��ɫ��ʧ������ �������о�Ӱ�췴Ӧ���ʵ����ء�
I.ʵ��ǰ������Ũ��Ϊ 0.1000 mol/L ���� KMnO4 ����Һ�ζ�δ֪Ũ�ȵIJ�����Һ��
��1��д���ζ������з�����Ӧ�����ӷ���ʽ ��
��2�������й�һ�����ʵ���Ũ����Һ���Ƶ�˵������ȷ���� ��
A���� 15.8 g KMnO4 �������� 1 L ˮ��������Һ���ʵ���Ũ��Ϊ 0.1 mol/L
B���� 0.01 mol KMnO4 ����Ͷ�� 100 mL ����ƿ�м�ˮ���̶��ߣ������Ũ��Ϊ 0.1 mol/L
C����Ҫ 90 mL 0.1 mol/L �� KMnO4 ��Һ��Ӧȷ���� KMnO4 ���� 1 58 g
D������ʱ��������ƿ���̶��߶�������ʹ���Ƶ���ҺŨ��ƫ��
II.ͨ���ζ�ʵ��õ�������Һ��Ũ��Ϊ 0.2000 mol/L���øò�����Һ���±����к���ʵ��(ÿ��ʵ�������Һ��������Ϊ 8.00 mL)��
ʵ���� | �¶�(��) | ��������(g) | ���Ը������ ��Һ | |
���(mL) | Ũ��(mol/L) | |||
1 | 25 | 0.5 | 4.00 | 0.1000 |
2 | 50 | 0.5 | 4.00 | 0.1000 |
3 | 25 | 0.5 | 4.00 | 0.0100 |
4 | 25 | 0 | 4.00 | 0.1000 |
��3��д������ʵ�� 1 ��ʵ�� 2 ��ʵ��Ŀ�ģ� ��
��4����С��ͬѧ��ʵ�� 1 ��ʵ�� 3 �ֱ����������ʵ�飬�������ʵ������(�ӻ�����ȿ�ʼ��ʱ)��
ʵ�� ��� | ��Һ��ɫ����ʱ�� (min) | ||
�� 1 �� | �� 2 �� | �� 3 �� | |
1 | 14.0 | 13.0 | 11.0 |
2 | 6.5 | 6.7 | 6.8 |
�����������ݺ�ó�������������ͬʱ�����Ը��������Һ��Ũ��ԽС����ɫʱ���Խ�̣�����Ӧ���ʾ�Խ�����Ľ��ۡ���ͬѧ��Ϊ��С����̽����Ӧ��Ũ�ȶ�����Ӱ������ʵ�鷽������д������⣬�Ӷ��õ��˴����ʵ����ۣ���ͬѧ�Ľ���ʵ�鷽�����������ͬѧ�Ľ� ��ʵ�鷽��______________��
��5����ʵ����ʹ�õĴ���Ӧѡ�� MnSO4 ���� MnCl2��ԭ��������ӷ���ʽ��ʾΪ________��
III.��ҵ�Ͽ������̿�(��Ҫ�ɷ�Ϊ MnO2)���������������Ʊ�������ء�
�������̿���ȡ�õ� MnO2��Ȼ���� MnO2��KOH �����ڻ������ͨ��������Ƶ������(K2MnO4)��
�����������Һ��ͨ��CO2�ɻ�ø�����ء�
��6�����������������У������ڻ������ͨ�����ʱ������Ӧ�Ļ�ѧ����ʽ��______________��
��7�����������Һ��ͨ��CO2�ɻ�ø�����أ��÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2CO3��Һ�еμ����ᣬ��Ӧ�����������仯����ͼ��ʾ������˵����ȷ����
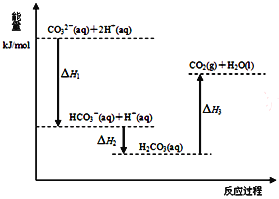
A. ��ӦHCO3-(aq)+H+(aq)��CO2(g)+H2O(l)Ϊ���ȷ�Ӧ
B. H1��H2 H2��H3
C. CO32-(aq)+2H+(aq)��CO2(g)+H2O(l) H��(H1+H2+H3)
D. H2CO3(aq)��CO2(g)+H2O(l)����ʹ�ô�������H3��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й������ĸ����õ绯ѧװ�õ���������ȷ����( )

A��ͼ����ʾ����У������缫��ӦΪZn-2e-![]() Zn2+
Zn2+
B��ͼ����ʾ��طŵ�����У�����Ũ�Ȳ�������
C��ͼ����ʾװ�ù��������У��������Һ��Cu2+Ũ��ʼ�ղ���
D��ͼ����ʾ����У�Ag2O������������ع��������б���ԭΪAg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1L0.1mol��L-1NH4Cl��Һ��,���ϼ������NaOH��,NH4+��NH3��H2O�ı仯������ͼ��ʾ(��������Һ����ı仯�Ͱ��Ļӷ�)������˵����ȷ���ǣ� ��

A. M����Һ��ˮ�ĵ���̶ȱ�ԭ��Һ��
B. a=0.05
C. ��n(NaOH)=0.05molʱ��Һ���У�c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D. ��M��ʱ,n(OH-)-n(H+)=(a-0.05)mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��װ�õ��һ������CuSO4��Һ��M��NΪ���Ե缫��������ʵ��������ͼ����ʾ��X���ʾ��������ת�Ƶ��ӵ����ʵ�����Y���ʾ�����̲���������������������˵������ȷ���ǣ�������
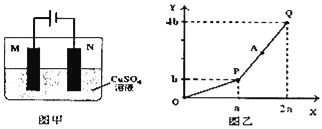
A. A��������Һֻ�����һ������CuO����Ϳɻָ�����ʼ״̬
B. ��������N�缫�������к�ɫ�������ɣ��������ݲ���
C. Q��ʱM��N���缫�ϲ�����������������ͬ�����������ͬ
D. ��M�缫���ϻ���Cu���缫�����������CuSO4��Һ��Ũ�Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������װ���йص�˵����ȷ���ǣ� ��
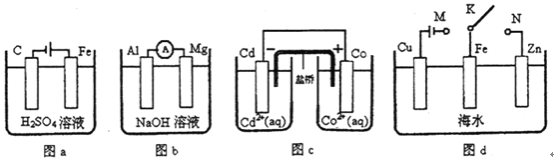
A. ͼa�У����ŵ��Ľ�����Һ��H+��Ũ��Խ��Խ��
B. ͼb�У�Mg�缫����صĸ���
C. ͼc�У������ķ�ӦΪCo+Cd2+= Cd+Co2+
D. ͼd�У�K�ֱ���M��N���ӣ�Fe�缫���ܵ��������ḯʴ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com