
����Ŀ���߷��Ӳ���E�ͺ�����Ϣʹ�߷���ҩ��ĺϳ�������ͼ��ʾ��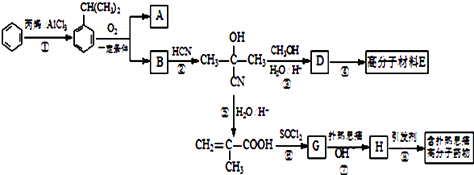
��֪��������Ϣʹ�߷���ҩ��ĽṹΪ�� 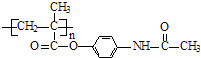
�� ![]()
�� ![]()
�Իش��������⣺
��1���ٵķ�Ӧ����Ϊ �� G�ķ���ʽΪ ��
��2����1mol 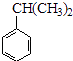 ��ת��Ϊ1mol A��1molB����A��FeCl3��Һ��������ɫ��д��A��ϡ��Һ�����Ũ��ˮ������Ӧ�Ļ�ѧ����ʽ����
��ת��Ϊ1mol A��1molB����A��FeCl3��Һ��������ɫ��д��A��ϡ��Һ�����Ũ��ˮ������Ӧ�Ļ�ѧ����ʽ����
��3����Ӧ��Ϊ�ӳɷ�Ӧ����B�Ľṹ��ʽΪ������Ϣʹ�Ľṹ��ʽΪ ��
��4��D�����ܶ�����ͬ״̬�¼����ܶȵ�6.25����D�и�Ԫ�ص����������ֱ�Ϊ̼60%����8%����32%��D����������������Ϊ ��
��5��1mol������Ϣʹ�߷���ҩ�������루��NaOHmol������������Һ������Ӧ��
���𰸡�
��1���ӳɷ�Ӧ��C4H5OCl
��2��
��3��![]() ��
��![]()
��4��̼̼˫��������
��5��3n
���������⣺���ͱ�ϩ���Ȼ������������·����ӳɷ�Ӧ�����챽���飬�챽���鱻��������A��B��B�������ᷢ���ӳɷ�Ӧ���� ![]() ����BΪ��ͪ��1mol
����BΪ��ͪ��1mol  ��ת��Ϊ1mol A��1mol B����A��FeCl3��Һ��������ɫ��˵��A�к��з��ǻ�������̼ԭ���غ�֪A�DZ��ӣ�
��ת��Ϊ1mol A��1mol B����A��FeCl3��Һ��������ɫ��˵��A�к��з��ǻ�������̼ԭ���غ�֪A�DZ��ӣ� ![]() ������Ӧ����D��D�����ܶ�����ͬ״̬�¼����ܶȵ�6.25������D����Է���������100��D�и�Ԫ�ص����������ֱ�Ϊ̼60%����8%����32%����̼���⡢��ԭ�Ӹ�����=
������Ӧ����D��D�����ܶ�����ͬ״̬�¼����ܶȵ�6.25������D����Է���������100��D�и�Ԫ�ص����������ֱ�Ϊ̼60%����8%����32%����̼���⡢��ԭ�Ӹ�����= ![]() ��
�� ![]() ��
�� ![]() =5��8��2��D����Է���������100����D�ķ���ʽΪ��C5H8O2 �� D�IJ����Ͷ�Ϊ��
=5��8��2��D����Է���������100����D�ķ���ʽΪ��C5H8O2 �� D�IJ����Ͷ�Ϊ�� ![]() =2������D�к���̼̼˫�����Һ�����������D�Ľṹ��ʽΪ��CH2=C��CH3��COOCH3��D�����Ӿ۷�Ӧ����E�����ϩ���SOCl2����ȡ����Ӧ����G��G�Ľṹ��ʽΪ��CH2=C��CH3��COCl��G��Ӧ����H��H��Ӧ����
=2������D�к���̼̼˫�����Һ�����������D�Ľṹ��ʽΪ��CH2=C��CH3��COOCH3��D�����Ӿ۷�Ӧ����E�����ϩ���SOCl2����ȡ����Ӧ����G��G�Ľṹ��ʽΪ��CH2=C��CH3��COCl��G��Ӧ����H��H��Ӧ���� 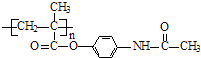 ����HΪ
����HΪ 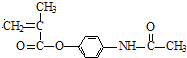 ����1��ͨ�����Ϸ���֪�����ͱ�ϩ�����ӳɷ�Ӧ�����챽���飬���Ԣٵķ�Ӧ����Ϊ�ӳɷ�Ӧ��G�ķ���ʽΪ C4H5OCl�����Դ��ǣ��ӳɷ�Ӧ��C4H5OCl����2��A�DZ��ӣ����Ӻ���ˮ����ȡ����Ӧ����Ӧ����ʽΪ��
����1��ͨ�����Ϸ���֪�����ͱ�ϩ�����ӳɷ�Ӧ�����챽���飬���Ԣٵķ�Ӧ����Ϊ�ӳɷ�Ӧ��G�ķ���ʽΪ C4H5OCl�����Դ��ǣ��ӳɷ�Ӧ��C4H5OCl����2��A�DZ��ӣ����Ӻ���ˮ����ȡ����Ӧ����Ӧ����ʽΪ�� 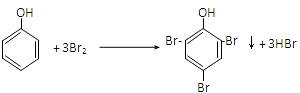 �����Դ��ǣ�
�����Դ��ǣ�  ����3��ͨ�����Ϸ���֪��B�Ľṹ��ʽΪ��
����3��ͨ�����Ϸ���֪��B�Ľṹ��ʽΪ�� ![]() ������Ϣʹ�Ľṹ��ʽΪ��
������Ϣʹ�Ľṹ��ʽΪ�� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� ![]() ����4��D�и�Ԫ�ص����������ֱ�Ϊ̼60%����8%����32%����̼���⡢��ԭ�Ӹ�����
����4��D�и�Ԫ�ص����������ֱ�Ϊ̼60%����8%����32%����̼���⡢��ԭ�Ӹ����� ![]() ��
�� ![]() ��
�� ![]() =5��8��2��D����Է���������100����D�ķ���ʽΪ��C5H8O2 �� D�IJ����Ͷ�Ϊ��
=5��8��2��D����Է���������100����D�ķ���ʽΪ��C5H8O2 �� D�IJ����Ͷ�Ϊ�� ![]() =2������D�к���̼̼˫�����Һ������������Դ��ǣ�̼̼˫������������5������Ϣʹ�߷���ҩ������������������Һ������Ӧ�Ļ�ѧ����ʽΪ��
=2������D�к���̼̼˫�����Һ������������Դ��ǣ�̼̼˫������������5������Ϣʹ�߷���ҩ������������������Һ������Ӧ�Ļ�ѧ����ʽΪ�� 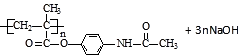 ��
�� ![]() �� ���Դ��ǣ�3n��
�� ���Դ��ǣ�3n��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��һ�������´ﵽ��ѧ��Ӧ��ʱ
A. ��Ӧֹͣ��B. ����Ӧ�������淴Ӧ���ʾ�Ϊ��
C. ��Ӧ��ȫ��ת����������D. ��Ӧ���������Ũ�Ȳ��ٷ����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����������ԼΪ1.0L�ĺ����ܱ������з�����Ӧ��2CH3OH��g���TCH3OCH3��g��+H2O��g��������˵����ȷ���ǣ� ��
���� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | ||
I | 387 | 0.20 | 0.080 | 0.080 |
�� | 387 | 0.40 | ||
�� | 207 | 0.20 | 0.090 | 0.090 |
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.�ﵽƽ��ʱ������I�е�CH3OH����������������е�С
C.����I�з�Ӧ�ﵽƽ������ʱ����������еij�
D.����ʼʱ������I�г���CH3OH 0.1mol��CH3OCH30.15mol��H2O 0.10mol����Ӧ��������Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ���Al2O3��������Fe2O3��SiO2�����ʡ�
����������������ȡ����������������ͼ��ʾ��
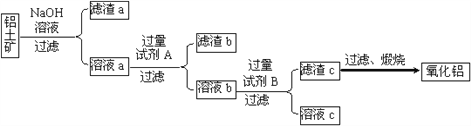
��1���Լ�A��________����Һb���Լ�B��Ӧ�����ӷ���ʽΪ________��
��2������NaOH��Һ���еķ�Ӧ�����ӷ���ʽΪ_________��____________��
���������մɵ����������������ַ����Ʊ�
��3�������������»�ԭ������Al2O3 +��C +�� N2 ![]() ����AlN +��CO������ƽ��
����AlN +��CO������ƽ��
���Ȼ����백�����ºϳɷ���AlCl3+NH3 ![]() AlN+3HCl
AlN+3HCl
��4�������ڱȷ������������ϸ������ơ�����˵���У���ȷ����_______��
A���������е� Al2O3��C��N2�ṹ�ȶ�����Ӧʱ�ƻ���ѧ����Ҫ���ĸ��������
B���������е�Al2O3��C���ײ����ڵ�������
C�����ַ����е�������Ϊ��ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX�ȱ�ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ1��ʾ��
�����жϳ���Ԫ�ػش����⣺
��1��z��Ԫ�����ڱ���λ���� ��
��2���Ƚ�d��f�����ӵİ뾶��С���û�ѧ���ű�ʾ����ͬ�������Ƚ�d��gԪ�صļ���̬�⻯����ȶ��Դ�С�� ��
��3����ѡ����Ԫ�����һ����ԭ�ӹ��ۻ����д�������ʽ ��
��4����֪1mol����e�ĵ���������d2������ȼ�գ��ָ������£��ų�255.5kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��5��������Ԫ����ɵ����ӻ����� Q��eh ��W��e2gd4 �� ����⺬2molQ��2molW�Ļ��ˮ��Һ������������44.8L���壨��״���£��Ҳ�����������ܽ����ʧ��ʱ����·��ת�Ƶ��ӵ����ʵ���Ϊmol��
��6������Ԫ�ؿ������R��zx4f��gd4��2 �� ��ʢ��10mL1molL��1R��Һ���ձ��еμ�1molL��1 NaOH��Һ���������ʵ�����NaOH��Һ����仯ʾ��ͼ��ͼ2����R��Һ�У�����Ũ���ɴ�С��˳���� ��
��д��m�㷢����Ӧ�����ӷ���ʽ ��
������R��Һ�иļ�20mL 1.2molL��1Ba��OH��2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊmol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ռ���Ʒ�к����������������õĿ��������ʣ�Ϊ�˲ⶨ�䴿�ȣ��������µζ�������
A����250mL����ƿ�ж��ݳ�250mL�ռ���Һ
B������Һ����ȡ25mL�ռ���Һ����ƿ�в��μӼ��μ���ָʾ��
C������ƽ��ȷ��ȡ�ռ���ƷWg�����ձ��м�����ˮ�ܽ�
D�������ʵ���Ũ��ΪM mol/L�ı�H2SO4��Һװ����ʽ�ζ��ܣ�����Һ�棬���¿�ʼ�̶�ΪV1mL
E������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬��¼�յ�̶�ΪV2mL
�ش��������⣺
��1����ȷ�IJ��������˳���ǣ�����ĸ��д�� ��
��2���ζ��ܶ���Ӧע�� ��
��3������E�е���ƿ�µ�һ�Ű�ֽ�������� ��
��4������D��Һ��Ӧ������ �� ���첿��Ӧ ��
��5���ζ��յ�ʱ��ƿ����Һ��pH ԼΪ �� �յ�ʱ��ɫ�仯�� ��
��6������ʽ�ζ���û���ñ�H2SO4��ϴ����Բⶨ����к�Ӱ�����ƫ�ߡ���ƫ�͡�����Ӱ�족��������������ȷ��
��7�����ռ���Ʒ�Ĵ��ȼ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ռ���Ʒ�к����������������õĿ��������ʣ�Ϊ�˲ⶨ�䴿�ȣ��������µζ�������
A����250mL����ƿ�ж��ݳ�250mL�ռ���Һ
B������Һ����ȡ25mL�ռ���Һ����ƿ�в��μӼ��μ���ָʾ��
C������ƽ��ȷ��ȡ�ռ���ƷWg�����ձ��м�����ˮ�ܽ�
D�������ʵ���Ũ��ΪM mol/L�ı�H2SO4��Һװ����ʽ�ζ��ܣ�����Һ�棬���¿�ʼ�̶�ΪV1mL
E������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬��¼�յ�̶�ΪV2mL
�ش��������⣺
��1����ȷ�IJ��������˳���ǣ�����ĸ��д�� ��
��2���ζ��ܶ���Ӧע�� ��
��3������E�е���ƿ�µ�һ�Ű�ֽ�������� ��
��4������D��Һ��Ӧ������ �� ���첿��Ӧ ��
��5���ζ��յ�ʱ��ƿ����Һ��pH ԼΪ �� �յ�ʱ��ɫ�仯�� ��
��6������ʽ�ζ���û���ñ�H2SO4��ϴ����Բⶨ����к�Ӱ�����ƫ�ߡ���ƫ�͡�����Ӱ�족��������������ȷ��
��7�����ռ���Ʒ�Ĵ��ȼ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����IIA��Ԫ�ؾ������ƵĻ�ѧ���ʣ����������ǵ�ԭ�Ӿ�����ͬ��
A��ԭ�Ӱ뾶 B�����Ӳ��� C����������� D������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƽ���л�ѧ����ʽ�����У�3����˫���ű��ת�Ƶĵ�����
��1�� Cu + HNO3(ϡ) �� Cu(NO3)2 + NO�� + H2O___________
��2�� S+ NaOH�� Na2S+ Na2SO3+ H2O_______________
��3�� KClO3�� HCl�� KCl�� Cl2���� H2O_____________
��4�� Cr2O72-+ Fe2++ �� Cr3++ Fe3++ ��_________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com