
����Ŀ��ij�ռ���Ʒ�к����������������õĿ��������ʣ�Ϊ�˲ⶨ�䴿�ȣ��������µζ�������
A����250mL����ƿ�ж��ݳ�250mL�ռ���Һ
B������Һ����ȡ25mL�ռ���Һ����ƿ�в��μӼ��μ���ָʾ��
C������ƽ��ȷ��ȡ�ռ���ƷWg�����ձ��м�����ˮ�ܽ�
D�������ʵ���Ũ��ΪM mol/L�ı�H2SO4��Һװ����ʽ�ζ��ܣ�����Һ�棬���¿�ʼ�̶�ΪV1mL
E������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬��¼�յ�̶�ΪV2mL
�ش��������⣺
��1����ȷ�IJ��������˳���ǣ�����ĸ��д�� ��
��2���ζ��ܶ���Ӧע�� ��
��3������E�е���ƿ�µ�һ�Ű�ֽ�������� ��
��4������D��Һ��Ӧ������ �� ���첿��Ӧ ��
��5���ζ��յ�ʱ��ƿ����Һ��pH ԼΪ �� �յ�ʱ��ɫ�仯�� ��
��6������ʽ�ζ���û���ñ�H2SO4��ϴ����Բⶨ����к�Ӱ�����ƫ�ߡ���ƫ�͡�����Ӱ�족��������������ȷ��
��7�����ռ���Ʒ�Ĵ��ȼ���ʽ�� ��
���𰸡�
��1��C��A��B��D��E
��2���ζ��ܴ�ֱ��Һ�治�ٱ仯ʱ�ſɶ�������������Һ��Һ����͵���ƽ��������ȷ��0.01ml
��3������ȷ�ж��յ�ʱ��ɫ�ı仯���
��4�����ڵ���̶Ȼ������µ�ijһ�̶ȣ�������H2SO4��Һ
��5��4����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ�Ϊԭ������ɫ
��6��ƫ��
��7��![]() ��100%
��100%
���������⣺��1��ʵ��ʱӦ�ȳ���һ�������Ĺ��壬�ܽ�����Ƴ���Һ����ȡ����Һ����ƿ�У�Ȼ���ñ�Һ���еζ������岽��Ϊ�� C������ƽ��ȷ��ȡ�ռ���ƷWg�����ձ��м�����ˮ�ܽ�A����250mL����ƿ�ж��ݳ�250mL�ռ���ҺB������Һ����ȡ25mL�ռ���Һ����ƿ�в��μӼ��μ���ָʾ��D�������ʵ���Ũ��ΪM mol/L�ı�H2SO4��Һװ����ʽ�ζ��ܣ�����Һ�棬���¿�ʼ�̶�ΪV1mLE������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬��¼�յ�̶�ΪV2mL���Դ��ǣ�C��A��B��D��E����2���ζ��ܴ�ֱ��Һ�治�ٱ仯ʱ�ſɶ�������������Һ��Һ����͵���ƽ���ζ��ܶ���ȷ��0.01ml�����Դ��ǣ��ζ��ܴ�ֱ��Һ�治�ٱ仯ʱ�ſɶ�������������Һ��Һ����͵���ƽ��������ȷ��0.01ml����3������ƿ�µ�һ�Ű�ֽʹ�ζ��յ���ɫ�仯�����ԣ����ڷֱ棬���Դ��ǣ�����ȷ�ж��յ�ʱ��ɫ�ı仯�������4���ζ���0�̶����ϣ��ζ�ǰӦ���ڵ���̶Ȼ������µ�ijһ�̶ȣ�Ϊ��С�����첿��Ӧ����Һ�壬�����ݣ����Դ��ǣ����ڵ���̶Ȼ������µ�ijһ�̶ȣ�������H2SO4��Һ�� 4.4���յ�ʱpHԼΪ4����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ�Ϊԭ������ɫ�����Դ��ǣ�4����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ�Ϊԭ������ɫ����6�����ҺŨ�ȱ�С������������Դ��ǣ�ƫ�ߣ���7���ε����ĵ�����Ϊ��n�����ᣩ=cV=��V2��V1����10��3L��Mmol/L�����ݷ�Ӧ���̿�֪��n��NaOH��=2n�����ᣩ=2M��V2��V1����10��3mol������ԭ����Ʒ���������Ƶ����ʵ���Ϊ��2M��V2��V1����10��3mol�� ![]() =2M��V2��V1����10��2mol������Ʒ���������Ƶ�����Ϊm��NaOH��=nM=80M��V2��V1����10��2g������ռ���Ʒ�Ĵ���Ϊ��
=2M��V2��V1����10��2mol������Ʒ���������Ƶ�����Ϊm��NaOH��=nM=80M��V2��V1����10��2g������ռ���Ʒ�Ĵ���Ϊ�� ![]() ��10��2��100%=
��10��2��100%= ![]() ��100%�����Դ��ǣ�
��100%�����Դ��ǣ� ![]() ��100%��
��100%��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ʹ���Ը��������Һ��ɫ����
A. ��B. ����C. ��ϩD. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ж���ȷ����
A. �˵������Al < Na B. �����ԣ�Na > Al
C. ԭ��������Na > Cl D. ԭ�Ӱ뾶��Cl > Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ��ʾ������������ͨ��ʢ�и������ɫ������ʪ�����ɫ�����Ĺ��ƿ���ɹ۲쵽��������__________________________________��
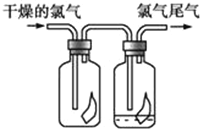
��2��д��C12��ˮ��Ӧ�Ļ�ѧ����ʽ________________________
��3��Ϊ��ֹ������Ⱦ��������������������Һ���ն����������ԭ����________________���û�ѧ����ʽ��ʾ����������һԭ������ҵ�ϳ������۵�ʯ�������չ�ҵ����β���Ƶ�Ư�ۣ�Ư�۵���Ч�ɷ���________���ѧʽ����ͬ����
��4������й©ʱ�������辡��Զ���ֳ������ý���һ��Ũ��ij����ˮ��Һ��ë����ס�ڱǣ������˲��õ�������__________��
A��NaOH B��NaCl C��KBr D��Na2CO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߷��Ӳ���E�ͺ�����Ϣʹ�߷���ҩ��ĺϳ�������ͼ��ʾ��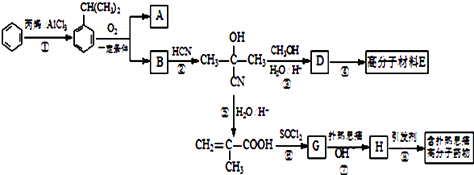
��֪��������Ϣʹ�߷���ҩ��ĽṹΪ�� 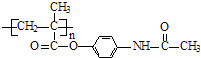
�� ![]()
�� ![]()
�Իش��������⣺
��1���ٵķ�Ӧ����Ϊ �� G�ķ���ʽΪ ��
��2����1mol  ��ת��Ϊ1mol A��1molB����A��FeCl3��Һ��������ɫ��д��A��ϡ��Һ�����Ũ��ˮ������Ӧ�Ļ�ѧ����ʽ����
��ת��Ϊ1mol A��1molB����A��FeCl3��Һ��������ɫ��д��A��ϡ��Һ�����Ũ��ˮ������Ӧ�Ļ�ѧ����ʽ����
��3����Ӧ��Ϊ�ӳɷ�Ӧ����B�Ľṹ��ʽΪ������Ϣʹ�Ľṹ��ʽΪ ��
��4��D�����ܶ�����ͬ״̬�¼����ܶȵ�6.25����D�и�Ԫ�ص����������ֱ�Ϊ̼60%����8%����32%��D����������������Ϊ ��
��5��1mol������Ϣʹ�߷���ҩ�������루��NaOHmol������������Һ������Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϣ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�Ʊ��״����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�������ʾ��
��ѧ��Ӧ | ƽ�ⳣ�� | �¶ȣ��棩 | |
500 | 800 | ||
��2H2��g��+CO��g��CH3OH��g�� | K1 | 2.5 | 0.15 |
��H2��g��+CO2��g��H2O��g��+CO��g�� | K2 | 1.0 | 2.5 |
��3H2��g��+CO2��g��CH3OH��g��+H2O��g�� | K3 | ||
��1����Ӧ����������ȡ����ȡ�����Ӧ��
��2��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ����ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K��A��K��B�����������������=������ 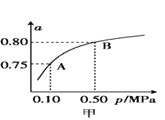
��3���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3=����K1��K2��ʾ����500��ʱ��÷�Ӧ����ijʱ��ʱ��H2��g����CO2��g����CH3OH��g����H2O��g����Ũ�ȣ�molL��1���ֱ�Ϊ0.8��0.1��0.3��0.15�����ʱv��v�����������=����������
��4����3L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ���֪c��CO����t����Ӧʱ�䣩�仯���ߢ���ͼ����ʾ������t0ʱ�̷ֱ�ı�һ�����������ߢ��Ϊ���ߢ�����ߢ�
�����ߢ��Ϊ���ߢ�ʱ���ı��������
�����ߢ��Ϊ���ߢ�ʱ���ı������ �� 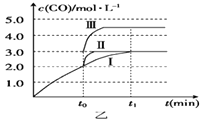
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Ũ������ľ̿���ڼ��������·�Ӧ�Ļ�ѧ����ʽΪ_______________________��
��� | �� | �� | �� | �� |
װ�� |
|
|
|
|
��2�����ñ�����ʾ��װ�����һ��ʵ��,��֤������Ӧ�������ĸ��ֲ��
��Щװ�õ�����˳��(���������������ҵķ���)��(��װ�õı��)����������������������������������������______________
��3��ʵ�����пɹ۲쵽װ�â���Aƿ����Һ��ɫ,Cƿ����Һ����ɫ��Bƿ��Һ��������___________��Cƿ��Һ��������________________��
��4��װ�â������ӵĹ���ҩƷ��__________��
��5��װ�â�����ʢ����Һ��___________������֤�IJ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ����;�dz��㷺�IJ�Ʒ���������������ᡢƯ�۵�һϵ�����ʣ�����ͼ��������˵����ȷ���ǣ� �� 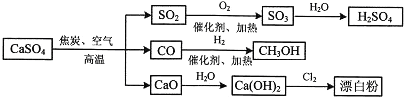
A.CO��SO2��SO3��������������
B.��ҵ������Cl2�ͳ���ʯ��ˮ��Ӧ����ȡƯ��
C.Ư�۵���Ч�ɷ�ΪCa��ClO��2
D.��ȥ��ˮ��Ӧ��������Ӧ��ͼʾ����ת����Ӧ��Ϊ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᣨH3PO2����һ�־�ϸ������Ʒ�����н�ǿ��ԭ�ԣ��ش��������⣺
��1��H3PO2��һԪ��ǿ�ᣬд������뷽��ʽ________________________________��
��2��H3PO2��NaH2PO2���ɽ���Һ�е�Ag+��ԭΪ�����Ӷ������ڻ�ѧ������
��H3PO2�У�PԪ�صĻ��ϼ�Ϊ__________��
������H3PO2���л�ѧ������Ӧ�У�����������ΪH3PO4ʱ���������뻹ԭ�������ʵ���֮��Ϊ__________��
��3��H3PO2�Ĺ�ҵ�Ʒ��ǣ�������(P4)��Ba(OH)2��Һ��Ӧ����PH3�����Ba(H2PO2)2����������H2SO4��Ӧ��д��������Ba(OH)2��Һ��Ӧ�Ļ�ѧ����ʽ:_____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com