
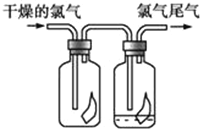
【题目】(1)如图所示,将氯气依次通过盛有干燥的有色布条和湿润的有色布条的广口瓶,可观察到的现象是__________________________________.
(2)写出C12与水反应的化学方程式________________________
(3)为防止氯气污染空气,可用氢氧化钠溶液吸收多余的氯气,原理是________________(用化学方程式表示).根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是________(填化学式,下同)。
(4)氯气泄漏时,人们需尽快远离现场,可用浸有一定浓度某物质水溶液的毛巾捂住口鼻,最适宜采用的物质是__________.
A.NaOH B.NaCl C.KBr D.Na2CO3.
【答案】 干燥的有色布条无明显现象,潮湿的有色布条褪色 Cl2+H2O=HCl+HClO Cl2+2NaOH=NaCl+NaClO+H2O Ca(ClO)2 D.
【解析】(1)氯气与水反应生成的次氯酸具有漂白性,所以干燥的氯气通过干燥的有色布条不会褪色,而通过潮湿的有色布条时,布条褪色;
(2) C12与水反应的化学方程式为Cl2+H2O=HCl+HClO
(3) C12能与NaOH溶液反应,所以可用氢氧化钠溶液吸收多余的氯气,反应原理为Cl2+ 2NaOH=NaCl+NaClO+H2O;C12与石灰乳反应制漂白粉的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,起漂白作用时Ca(ClO)2与水和CO2反应生成的HClO,所以漂白粉的有效成分为Ca(ClO)2。
(4)A、氯气能被NaOH溶液吸收,但NaOH溶液具有很强的腐蚀性,不能与皮肤接触,所以A错误;B、NaCl不能吸收氯气,故B错误;C、KBr能与氯气反应,但生成的溴单质同样有毒,所以C错误;D、氯气能被Na2CO3溶液吸收,且Na2CO3溶液对皮肤没有伤害,所以D正确。正确答案为D。


科目:高中化学 来源: 题型:
【题目】将250mL密度1.31g/cm3、质量分数为15%的硫酸与适量的铁屑充分反应.计算:
(1)此硫酸溶液中H2SO4的物质的量浓度;
(2)生成的H2的体积(标况);
(3)将生成的FeSO4配成400mL溶液,此溶液中Fe2+的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,汽车尾气已成为许多大城市空气的主要污染源。汽车尾气中含有CO、NO等多种污染物。
(1)汽车燃料中一般不含氮元素,尾气中所含的NO是如何产生的?说明原因并写出有关反应的化学方程式:__________________________________________________。
(2)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2。反应的化学方程式是____________________.。
(3)下列措施中,能减少或控制汽车尾气污染有效且可行的是__________。
①制定严格的汽车尾气排放标准,并严格执行。
②开发清洗能源汽车,如氢能汽车、太阳能汽车等。
③市民出行戴防护面具。
④市民大量移居城市郊区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,以石墨为电极电解A的水溶液,并做下面一系列实验.试根据实验现象完成下列问题(电解质A的水溶液焰色反应呈紫色).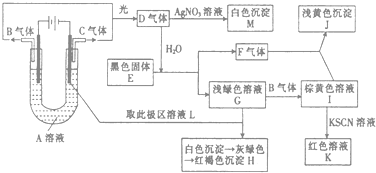
(1)A的化学式为 , E的名称为 .
(2)I和F反应的离子方程式是 .
(3)若将电解装置中的阳极换成铁棒,则在U型管底部可观察到的现象是 , 阳极的电极反应式为 , 阴极的电极反应式为 , 电解的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
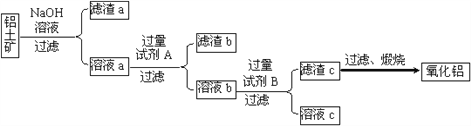
(1)试剂A是________;溶液b与试剂B反应的离子方程式为________。
(2)加入NaOH溶液进行的反应的离子方程式为_________、____________。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(3)①氧化铝高温还原法: Al2O3 + C + N2 ![]() AlN + CO(请配平)
AlN + CO(请配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 ![]() AlN+3HCl
AlN+3HCl
(4)方法②比方法①在生产上更具优势。下列说法中,正确的是_______。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写下列方程式:
(1)乙酸和乙醇的酯化反应方程式
(2)工业冶炼镁的化学方程式
(3)二氧化硅与氢氟酸化学方程式
(4)Na2SO3与FeCl3反应的离子方程式
(5)火法炼铜化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写) .
(2)滴定管读数应注意 .
(3)操作E中的锥形瓶下垫一张白纸的作用是 .
(4)操作D中液面应调整到 , 尖嘴部分应 .
(5)滴定终点时锥形瓶内溶液的pH 约为 , 终点时颜色变化是 .
(6)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响(填“偏高”“偏低”或“无影响”,其它操作均正确)
(7)该烧碱样品的纯度计算式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物分别是NaOH、NH3H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①0.001mol/L的A溶液pH=3;
②B溶液和D溶液显碱性,等浓度两者PH关系B<D;
③E是弱电解质.回答下列问题:
(1)D是溶液,判断理由是 .
(2)用水稀释0.1molL﹣1 B时,溶液中随着水量的增加而减小的是(填写序号).
① ![]() ②
② ![]() ③c(H+)和c(OH﹣)的乘积 ④OH﹣的物质的量
③c(H+)和c(OH﹣)的乘积 ④OH﹣的物质的量
(3)将等体积、等物质的量浓度B和C的溶液混合,升高温度(溶质不会分解)溶液pH随温度变化为图中的曲线(填写序号).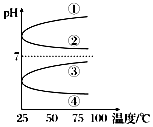
(4)OH﹣浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是(填写序号).
①反应所需要的时间E>A
②开始反应时的速率A>E
③参加反应的锌的物质的量A=E
④反应过程的平均速率E>A
⑤A溶液里有锌剩余
⑥E溶液里有锌剩余.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com