
����Ŀ��H2��I2��һ���������ܷ�����Ӧ��H2(g) + I2(g)![]() 2HI(g) ��H����a kJ��mol��1
2HI(g) ��H����a kJ��mol��1
��֪�� (a��b��c��������)
(a��b��c��������)
����˵������ȷ����( )
A. ��Ӧ��������������������������
B. �Ͽ�1 mol H��H����1 mol I��I�������������ڶϿ�2 mol H��I����������
C. �Ͽ�2 mol H��I����������ԼΪ(c+b+a) kJ
D. ���ܱ������м���2 mol H2��2 mol I2����ַ�Ӧ��ų�������С��2a kJ
���𰸡�B
��������A��H2��I2��һ���������ܷ�����Ӧ��H2��g��+I2��g��2HI��g����H=-a kJmol-1 ����Ӧ�Ƿ��ȷ�Ӧ����Ӧ�����������������A��ȷ��B�����ѻ�ѧ�������������γɻ�ѧ���ų���������Ӧ�Ƿ��ȷ�Ӧ�����γɻ�ѧ���ų����������ڶ��ѻ�ѧ�����յ��������Ͽ�1mol H-H����1mol I-I����������С�ڶϿ�2mol H-I��������������B����C����H=��Ӧ����ѻ�ѧ����Ҫ������-�������γɻ�ѧ���ų�������=bkJ/mol+ckJ/mol-2H-I=-akJ/mol���õ��Ͽ�2mol H-I����������ԼΪ��a+b+c��kJ����C��ȷ��D����Ӧ�ǿ��淴Ӧ���ܽ��г��ף������ʱ�������������ܱ������м���2mol H2��2mol I2����ַ�Ӧ��ų�������С��2a kJ����D��ȷ���ʴ�ΪB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������������Ӱ뾶�������Ӱ뾶��ֵ��С����
A. NaF B. KBr C. NaI D. MgI2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣�����������ĸ�ֱ����һ��Ԫ�أ�

�Իش��������⣺
��1������Ԫ���У�����d��Ԫ�ص���________����Ԫ�ط��ţ���h�����ڱ���λ����_________��
��2����e��f��ԭ�Ӹ���1��1�γɵľ����У���ѧ������Ϊ______________��
��3��Ԫ��k�Ļ�̬ԭ�ӵ����Ų�ʽΪ__________������c�ĺ�������Ų�ͼ��_____________��
��4��Ԫ��c�ĵ縺��______Ԫ��g�ĵ縺�ԣ����������=��������������Ԫ��b��c��e�ĵ�һ�������ɴ�С��˳����___________________����Ԫ�ط��ű�ʾ����
��5����ҵ��ұ��gԪ�صĵ��ʵĻ�ѧ����ʽ_______________________________��f�� h����Ԫ������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��CO2�����ԭΪCH4�Ĺ���ԭ��ʾ��ͼ������˵������ȷ����( )

A. �ù����ǵ���ת��Ϊ��ѧ�ܵĹ���
B. ͭ�缫�ĵ缫��ӦʽΪCO2+8H++8e-=CH4+2H2O
C. һ��ʱ����� ����n(KHCO3)����
D. һ��ʱ����� ������Һ��pHһ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ϵͳ�У���ʼ�¶�Ϊ25�棬��20.00mL0.1000mol/L�İ�ˮ����μ���0.1000mol/L��HC1��Һ����û����Һ���¶ȱ仯��ͼ��ʾ���������˵����ȷ����
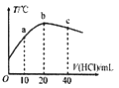
A. ��֪:25��ʱ��0.1000mol/L��ˮ�ĵ����Ϊ1.33%���ð�ˮ��pHԼΪ12
B. ��a����Һ�ʼ��ԣ���a����Һ��:c(NH4+)>c(Cl-)>c(NH3H2O)
C. b����ҺpH=7��c����ҺpH<7
D. b����Һ��: 0.1000mol/L +c(OH-)=c(Cl-)- c(NH3H2O)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ���������ȷ�Ӧ���ǣ� ��
A.п����ϡ����ķ�Ӧ
B.���ȵ�ľ̿��CO2�ķ�Ӧ
C.����������ˮ�ķ�Ӧ
D.Ba��OH��28H2O������NH4Cl����ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�����ǵ������緢չ��һ����Ҫ���⡣������Դ��������ɫ��ѧ���ĸ������
A.����B.úC.����D.ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ձ���ʢ��ŨHNO3�����ձ��з�����ͭ������������Ǧ�����缫����֪ԭ���ֹͣ����ʱ��Fe��Pb����ʣ�ࡣ�����й�˵����ȷ����(����) .

A. Fe��Pb���ã�ʼ��������
B. Fe��ŨHNO3�жۻ���ʼ�ղ����ܽ�
C. ���ֹͣ����ʱ���ձ���������Fe(NO3)3
D. ����ŨHNO3���������Һ�����ϡ���ɫ��ѧ��˼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����·�Ӧ�ɻ��������Դ������(CH3OCH3)������˵������ȷ����
��C(s)+H2O(g)=CO(g)+H2(g) ��H1=akJ/mol
��CO(g)+H2O(g)=CO2(g)+H2(g) ��H2=bkJ/mol
��CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ��H3=ckJ/mol
��2CH3OH(g)=CH3OCH3(g)+H2O(g) ��H4=dkJ/mol
A. ��Ӧ�١���Ϊ��Ӧ���ṩԭ��������a>0
B. ��Ӧ��Ҳ��CO2��Դ�����õķ���֮һ
C. ��ӦCH3OH(g)=1/2CH3OCH3(g)+1/2H2O(g) ��H=d/2kJ/mol
D. ��Ӧ2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)����H=-(2b+2c+d)kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com