
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
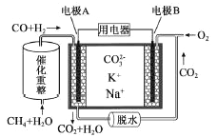
A. CH4+H2O![]() 3H2+CO,每消耗1mol CH4转移12mol电子
3H2+CO,每消耗1mol CH4转移12mol电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
D. 电池工作时,CO32-向电极B移动
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】下图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
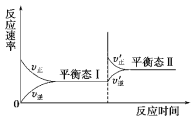
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝0.3mol分别放入100 mL 1mol.L-1 的盐酸中,在同温、同压下产生的气体体积比是
A.3:1:1 B.6:3:2 C.1:2:3 D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计正确的是
A.分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B.失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氧化铝溶液,可以用碳酸钱溶液鉴别
C.将CuC12溶液在蒸发皿中加热蒸千,得到无水CuCl2固体
D.检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品![]() 粉碎
粉碎![]() 加水溶解
加水溶解![]() 过滤
过滤![]() 向滤液中滴加KSCN 溶液
向滤液中滴加KSCN 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关CuSO4溶液的叙述中正确的是
A. 该溶液呈电中性
B. 它与H2S反应的离子方程式为:Cu2++S2-=CuS↓
C. 用惰性电极电解该溶液时,阳极产生铜单质
D. 在溶液中:c (Cu2+) +c (H+)=c(SO42-) +c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学健断裂时吸收的能量与化学健形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
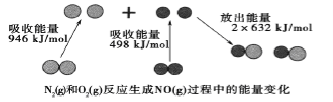
A.1molN2(g)和1molO2(g)反应放出的能量为180kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.在1L的容器中发生反应.10min内N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L·min)
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
钒(12V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒价层电子排布图为 ,比钒质子数大1的元素原子的电子排布式为 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的转化剂。SO2分子VSEPR模型是 ,硫原子杂化类型为 ;SO3气态为单分子,SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S——O键长有两类,一类键长约140pm,另一类键长约为160pm,较长的键为 (填图2字母),该分子含有 个σ键。
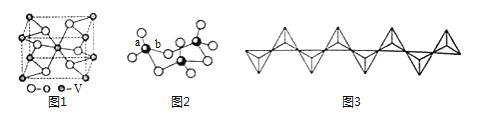
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构(钒位于体心),则偏钒酸钠的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
①已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。
②CrO2-是一种酸根离子,则Fe(CrO2)2属于__ _(填“酸”、“碱”、“盐”或“氧化物”)。
③明胶的水溶液和K2SO4溶液共同具备的性质是 。
A.都不稳定,密封放置会产生沉淀
B.两者均有丁达尔现象
C.分散质粒子都可通过滤纸
Ⅱ.Cr是一种银白色金属,化学性质稳定,以+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
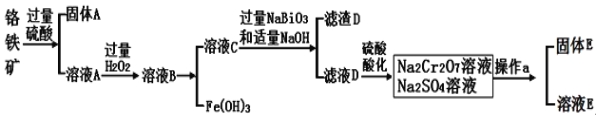
查阅资料:
常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,用硫酸而不选用盐酸,可能的原因是 。
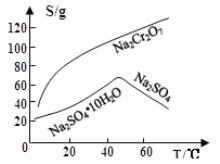
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;(用离子方程式表示)
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期元素X,其原子的电子层数为n,最外层电子数为2n+1。下列有关元素X的说法错误的是( )
A. 元素X不可能是金属元素
B. 元素X的气态氢化物不一定是电解质
C. 元素X一定能形成化学式为KXO3的含氧酸钾盐
D. 工业上制取X的单质时一定采用氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com