
【题目】将钠、镁、铝0.3mol分别放入100 mL 1mol.L-1 的盐酸中,在同温、同压下产生的气体体积比是
A.3:1:1 B.6:3:2 C.1:2:3 D.1:1:1
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中发生反应aX(g)![]() bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )
A.可逆反应的化学方程式的化学计量数:a>b+c
B.压缩容器的容积时,v(正)增大,v(逆)减小
C.达到新平衡时,物质X的转化率减小
D.达到新平衡时,混合物中Z的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g)![]() pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
压强/Pa | 2×105 | 5×105 | 1×106 |
c(A)/(mol·L-1) | 0.08 | 0.20 | 0.44 |
分析表中数据,回答:
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 (填“向左”“向右”或“不”)移动,理由是 。
(2)当压强从5×105 Pa增加到1×106 Pa时,该反应的化学平衡 移动,判断的依据是 ,可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是( )
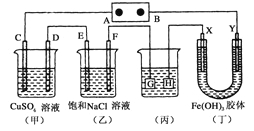
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:3:2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代人已经进入以“室内污染”为标志的第三个污染阶段,以下不属于室内污染物的是( )
A.烹饪时产生的油烟
B.石材缓慢释放的放射性气体
C.各种板材中粘合剂释放的甲醛等
D.天然气燃烧产生的CO2和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.放热反应在任何条件都能自发进行
B.应用盖斯定律,可计算某些难以直接测量的反应焓变
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
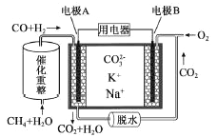
A. CH4+H2O![]() 3H2+CO,每消耗1mol CH4转移12mol电子
3H2+CO,每消耗1mol CH4转移12mol电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
D. 电池工作时,CO32-向电极B移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水。向一定量的W的最高价价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
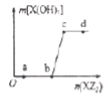
A.d点对应的溶液中:K+、NH4+、CO32-、I-
B.c点对应的溶液中:Ag+、Ca2+、NO3-、Na+
C.b点对应的溶液中:Na+、S2-、SO42-、Cl-
D.a点对应的溶液中:Na+、K+、SO42-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com