
【题目】反应mA(g)+nB(g)![]() pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
压强/Pa | 2×105 | 5×105 | 1×106 |
c(A)/(mol·L-1) | 0.08 | 0.20 | 0.44 |
分析表中数据,回答:
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 (填“向左”“向右”或“不”)移动,理由是 。
(2)当压强从5×105 Pa增加到1×106 Pa时,该反应的化学平衡 移动,判断的依据是 ,可能的原因是 。
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成四核10电子分子。试回答下列问题:
(1)A、B、C三种离子半径由小到大的顺序是(写离子符号)____________。
(2)C离子的结构示意图是_____________。
(3)用电子式表示A2B的形成过程__________。
(4)写出D元素形成的单质的结构式______________;
(5)写出下列物质的电子式:E2B2__________;D2E4__________;A、B、E形成的化合物__________.
(6)A、B两元素组成的化合物A2B2属于______________(“离子”“共价”)化合物,存在的化学键是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.
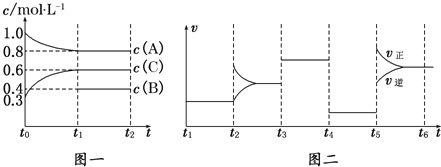
(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=______________.
(2)t4~t5阶段改变的条件为______________,B的起始物质的量为______________.
(3)判断图一中可逆反应达到平衡状态的依据是(填序号)______________.
①2v正(A)=3v逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:______________.
(5)容器乙与容器甲的体积相同且保持不变,且乙容器的温度恒定为甲容器t4~t5时的温度,若要使C的平衡浓度为1.2mol/L,则在乙容器中加入1.2molA、0.6molB的同时还需要加入___________molC。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
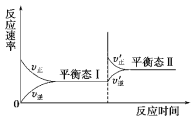
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它有双原子分子构成,它的摩尔质量为Mg.mol-1 。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为__________mol,(2)该气体所含原子总数为__________个。
(3)该气体在标准状况下该气体的体积为__________L。
(4)该气体溶于1L水中(不考虑反应),其所得溶液中溶质的质量分数为__________。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为__________mol.L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,放出了X kJ热量。已知碳完全燃烧的焓变△H= 一Y kJ·mol-1,则lmol C与O2反应生成CO的反应热△H为 ( ) kJ·mol-1
A.一Y B.—(10X—Y) C.一(5X—O.5Y) D.+(10X—Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝0.3mol分别放入100 mL 1mol.L-1 的盐酸中,在同温、同压下产生的气体体积比是
A.3:1:1 B.6:3:2 C.1:2:3 D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
钒(12V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒价层电子排布图为 ,比钒质子数大1的元素原子的电子排布式为 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的转化剂。SO2分子VSEPR模型是 ,硫原子杂化类型为 ;SO3气态为单分子,SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S——O键长有两类,一类键长约140pm,另一类键长约为160pm,较长的键为 (填图2字母),该分子含有 个σ键。
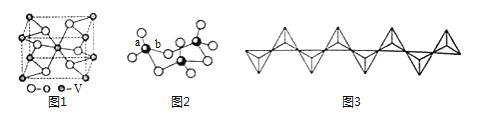
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构(钒位于体心),则偏钒酸钠的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com