
【题目】下列有关说法正确的是( )
A.放热反应在任何条件都能自发进行
B.应用盖斯定律,可计算某些难以直接测量的反应焓变
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出.
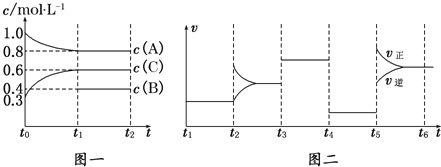
(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=______________.
(2)t4~t5阶段改变的条件为______________,B的起始物质的量为______________.
(3)判断图一中可逆反应达到平衡状态的依据是(填序号)______________.
①2v正(A)=3v逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:______________.
(5)容器乙与容器甲的体积相同且保持不变,且乙容器的温度恒定为甲容器t4~t5时的温度,若要使C的平衡浓度为1.2mol/L,则在乙容器中加入1.2molA、0.6molB的同时还需要加入___________molC。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,放出了X kJ热量。已知碳完全燃烧的焓变△H= 一Y kJ·mol-1,则lmol C与O2反应生成CO的反应热△H为 ( ) kJ·mol-1
A.一Y B.—(10X—Y) C.一(5X—O.5Y) D.+(10X—Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝0.3mol分别放入100 mL 1mol.L-1 的盐酸中,在同温、同压下产生的气体体积比是
A.3:1:1 B.6:3:2 C.1:2:3 D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C分别充入等质量的X、H2、Y三种气体。当隔板静止时,A、C内的气体密度相等,下列说法不正确的是

A.摩尔质量:M(X)=M(Y) B.分子的数目:N(X)=N(Y)
C.气体的体积:V(X)=V(Y) D.物质的质量:m(X)<n(H2)<n(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计正确的是
A.分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B.失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氧化铝溶液,可以用碳酸钱溶液鉴别
C.将CuC12溶液在蒸发皿中加热蒸千,得到无水CuCl2固体
D.检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品![]() 粉碎
粉碎![]() 加水溶解
加水溶解![]() 过滤
过滤![]() 向滤液中滴加KSCN 溶液
向滤液中滴加KSCN 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关CuSO4溶液的叙述中正确的是
A. 该溶液呈电中性
B. 它与H2S反应的离子方程式为:Cu2++S2-=CuS↓
C. 用惰性电极电解该溶液时,阳极产生铜单质
D. 在溶液中:c (Cu2+) +c (H+)=c(SO42-) +c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
钒(12V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒价层电子排布图为 ,比钒质子数大1的元素原子的电子排布式为 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的转化剂。SO2分子VSEPR模型是 ,硫原子杂化类型为 ;SO3气态为单分子,SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S——O键长有两类,一类键长约140pm,另一类键长约为160pm,较长的键为 (填图2字母),该分子含有 个σ键。
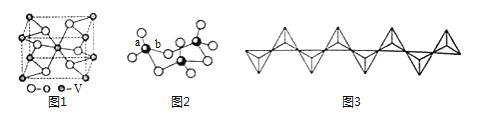
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构(钒位于体心),则偏钒酸钠的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI;3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 = 2KSCN + CO2 ↑ + H2O;
KCN + CO2 + H2O = HCN + KHCO3
热分解反应:4NaClO![]() 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 ![]() NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是 ( )
A.酸性(水溶液):HSCN > H2CO3 > HCN
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com