
【题目】氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可生成CuH。下列叙述中错误的是( )
A.“某物质”具有还原性
B.CuH与盐酸反应可能产生H2
C.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
D.CuH与足量稀硝酸反应:CuH+3H++NO![]() =Cu2++NO↑+2H2O
=Cu2++NO↑+2H2O
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为 。
(2)锗、砷、硒的第一电离能大小排序为 。H2SeO4的酸性比H2SeO3的强,其原因是 。
(3)H2SeO3的中心原子杂化类型是 ;SeO32- 的立体构型是 。与SeO32- 互为等电体的分子有(写一种物质的化学式即可) 。
(4)H2Se属于 (填“极性”或“非极性”)分子;单质硒的熔点为217℃,它属于 晶体。
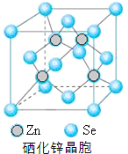
(5)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为 ;若该晶胞密度为ρgcm-3,硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为 pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )(可能用到的相对原子质量:O—16 Na—23)
A. 含1 mol FeCl3的饱和溶液最多可形成胶体粒子数为NA
B. 1 mol Fe溶于过量硝酸,电子转移数为2 NA
C. 100 mL 2 mol·L-1碳酸钠溶液中,CO![]() 离子数为0.2 NA
离子数为0.2 NA
D. 7.8 g过氧化钠与水反应时转移的电子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿酸是合成青蒿素的原料,可以由香草醛合成:
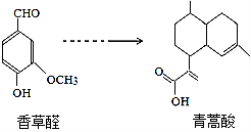
下列叙述正确的是( )
A.青蒿酸分子C15H14O2
B.在一定条件,香草醛可与HCHO发生缩聚反应
C.两种物质分别和H2反应,最多消耗H2 依次为4 mol和3 mol
D.可用FeCl3溶液或NaHCO3溶液鉴别化合物香草醛和青蒿酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 汽车大量排放未经处理的尾气是造成PM2.5值升高的原因之一
B. 将自然界中游离态的硅提纯所得的晶体硅可用于制作计算机芯片
C. “海水淡化”可以解决“淡水供应危机”,向海水中加入明矾可以使海水淡化
D. 煤的气化和液化过程分别是物理变化和化学变化,产品都是清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件后发生下列反应能够导致固体物质增重的是( )
A. 铝与Fe2O3发生铝热反应 B. 将锌粒投入Cu(NO3)2溶液
C. 氢气通过灼热的CuO粉末 D. 二氧化碳通过Na2O2粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
(l)冶炼废水中砷元素主要以亚砷酸(H3 AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:I .As2 S3与过量的S2一存在以下反应:As2S3(s)+3S2—(aq)![]() 2AsS33—(aq);
2AsS33—(aq);
II.亚砷酸盐的溶解性大于相应砷酸盐。
①亚砷酸中砷元素的化合价为 ;
②砷酸的第一步电离方程式为 ;
③“一级沉砷”中FeSO4的作用是 ;
④“二级沉砷”中H2O2与含砷物质反应的化学方程式为 ;
⑤沉淀X为 (填化学式)。
(2)冶炼废渣中的砷元素主要以As2O3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10 -6g)。
步骤1:取10 g废渣样品,粉碎后与锌粉混合,加人H2 SO4共热,生成H3As气体。
步骤2:将H3As气体通人AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
①AsH3的电子式为 ;
②步骤2的离子方程式为 ;
③固体废弃物的排放标准中,砷元素不得高于4.0×10一5g·kg一1,请通过计算说明该排放的废渣中砷元素的含量 (填“符合”、“不符合”)排放标准,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果实行海水淡化来供应居民饮用水,下列方法中在原理上完全不可行的是( )
A. 加明矾使海水中的盐沉淀出来而淡化
B. 利用太阳能使海水升温,通过蒸馏而使其淡化
C. 将海水缓慢降温凝固以获取淡水
D. 将海水通过离子交换树脂以除去金属阳离子及酸根阴离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com